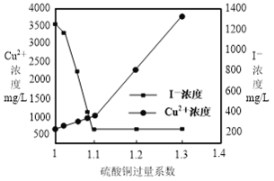
题目内容
【题目】一种镁氧电池如图所示,电极材料为金属镁和吸附氧气的活性炭,电解液为KOH浓溶液。下列说法错误的是
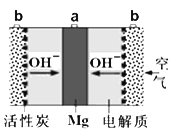
A. 电池总反应式为:2Mg+O2+2H2O=2Mg(OH)2
B. 正极反应式为:Mg-2e-=Mg2+
C. 活性炭一极为正极
D. 电子的移动方向由a经外电路到b
【答案】B
【解析】
Mg、活性炭、KOH浓溶液构成原电池,Mg易失电子作负极,活性炭为正极,负极反应式为Mg-2e-+2OH-=Mg(OH)2,正极反应式为O2+4e-+2H2O=4OH-,电子从负极沿外电路进入正极,据此分析解答;
Mg、活性炭、KOH浓溶液构成原电池,Mg易失电子作负极,活性炭为正极,负极反应式为Mg-2e-+2OH-=Mg(OH)2,正极反应式为O2+4e-+2H2O=4OH-,电子从负极沿外电路进入正极,
A、根据上述分析,负极反应式为Mg-2e-+2OH-=Mg(OH)2,正极反应式为O2+4e-+2H2O=4OH-,电池总反应式为2Mg+O2+2H2O=Mg(OH)2,故A说法正确;
B、根据上述分析,Mg为负极,电极反应式为Mg-2e-+2OH-=Mg(OH)2,故B说法错误;
C、活性炭为一极正极,故C说法正确;
D、根据原电池工作原理,电子从负极经外电路流向正极,即电子从a经外电路流向b,故D说法正确;
答案选B。

 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案【题目】下列离子方程式能用来解释相应实验现象的是( )
实验现象 | 离子方程式 | |
A | 向氢氧化镁悬浊液中滴加氯化铵溶液,沉淀溶解 |
|
B | 向沸水中滴加饱和氯化铁溶液得到红褐色液体 |
|
C | 二氧化硫使酸性高锰酸钾溶液褪色 |
|
D | 氧化亚铁溶于稀硝酸 |
|
A. AB. BC. CD. D
【题目】1869年俄国化学家门捷列夫制出第一张元素周期表,到现在形成的周期表经过了众多化学家的艰辛努力,历经142年,元素周期表体现了元素位构性的关系,揭示了元素间的内在联系。如图是元素周期表的一部分,回答下列问题。
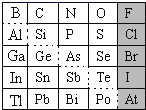
(1)根据元素周期律,推断:
①H3AsO4、H2SeO4的酸性强弱:H3AsO4___H2SeO4(填“>”、“<”或“=”)。
②氢化物的还原性:H2O___H2S(填“>”、“<”或“=”)。
(2)可在图中分界线(虚线部分)附近寻找___(填序号)。
A.优良的催化剂B.半导体材料C.合金材料D.农药
(3)①Se2Cl2常用作分析试剂,其电子式为___。
②硒(Se)化铟(In)是一种可应用于未来超算设备的新型半导体材料。下列说法正确的是___(填字母)。
A.原子半径:In>Se B.In的金属性比Se强
C.In的金属性比Al弱 D.硒化铟的化学式为InSe2
(4)请设计实验比较C、Si的非金属性强弱顺序(可供选择的药品有:CaCO3固体、稀硫酸、盐酸、饱和NaHCO3溶液、饱和Na2CO3溶液、硅酸钠溶液,化学仪器根据需要选择)。
实验步骤 | 实验现象与结论 |
在试管中加入___,再加入___,将生成气体通过___洗气后,通入___; | 现象:___;结论:非金属性C>Si |