题目内容
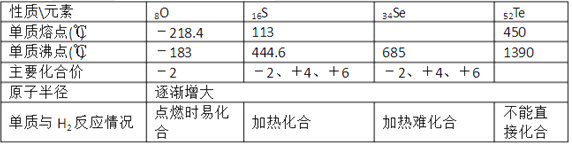
【题目】如表是ⅥA族部分元素的相关性质。
请回答下列问题:
(l)硒的熔点范围可能是____。
(2)碲的化合价可能有____。
(3)氢硒酸有较强的 ____填“氧化性”或“还原性”),因此放在空气中易变质,其可能发生反应的化学方程式为____。
(4)工业上Al2Te可用来制备H2Te,完成下列化学方程式:___ Al2Te3+___ =2Al(OH)3↓+____H2Te↑
【答案】113℃<Se<450℃ -2、+4、+6 还原性 2H2Se+O2=2H2O+2Se↓ 1 6H2O 3
【解析】
(1)由表中数据知,氧族元素单质的熔点随着原子序数增大而增大;
(2)由表中数据知,氧族元素主要化合价相似;
(3)元素的非金属性越弱,其氢化物的还原性越强,硒化氢易被氧气氧化生成Se和水;
(4)根据元素守恒知反应物还有水,根据原子守恒配平方程式.
(1)根据表中数据知,氧族元素单质的熔点随着原子序数增大而增大,所以Se的熔点介于S、Te之间,为113℃<Se<450℃;
(2)根据表中数据知,氧族元素主要化合价相似,根据元素化合价知,Te的化合价可能为-2、+4、+6;
(3)Se元素非金属性较弱,则其简单阴离子还原性较强,所以其氢化物具有还原性,硒化氢易被氧气氧化生成Se和水,反应方程式为2H2Se+O2=2H2O+2Se↓;
(4)根据元素守恒知反应物还有水,根据原子守恒配平方程式为Al2Te3+6H2O=2Al(OH)3↓+3H2Te。

 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案【题目】1869年俄国化学家门捷列夫制出第一张元素周期表,到现在形成的周期表经过了众多化学家的艰辛努力,历经142年,元素周期表体现了元素位构性的关系,揭示了元素间的内在联系。如图是元素周期表的一部分,回答下列问题。
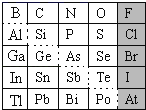
(1)根据元素周期律,推断:
①H3AsO4、H2SeO4的酸性强弱:H3AsO4___H2SeO4(填“>”、“<”或“=”)。
②氢化物的还原性:H2O___H2S(填“>”、“<”或“=”)。
(2)可在图中分界线(虚线部分)附近寻找___(填序号)。
A.优良的催化剂B.半导体材料C.合金材料D.农药
(3)①Se2Cl2常用作分析试剂,其电子式为___。
②硒(Se)化铟(In)是一种可应用于未来超算设备的新型半导体材料。下列说法正确的是___(填字母)。
A.原子半径:In>Se B.In的金属性比Se强
C.In的金属性比Al弱 D.硒化铟的化学式为InSe2
(4)请设计实验比较C、Si的非金属性强弱顺序(可供选择的药品有:CaCO3固体、稀硫酸、盐酸、饱和NaHCO3溶液、饱和Na2CO3溶液、硅酸钠溶液,化学仪器根据需要选择)。
实验步骤 | 实验现象与结论 |
在试管中加入___,再加入___,将生成气体通过___洗气后,通入___; | 现象:___;结论:非金属性C>Si |