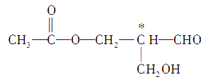题目内容
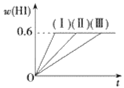
【题目】将1molI2(g)和2molH2置于5L密闭容器中,在一定温度下发生反应:I2(g)+H2(g)![]() 2HI(g)ΔH<0,并达到平衡。HI的体积分数w(HI)随时间变化如曲线(Ⅱ)所示:
2HI(g)ΔH<0,并达到平衡。HI的体积分数w(HI)随时间变化如曲线(Ⅱ)所示:
(1)达到平衡时,I2(g)的物质的量浓度为________。
(2)若改变反应条件,在甲条件下w(HI)的变化如曲线(Ⅰ)所示,在乙条件下w(HI)的变化如曲线(Ⅲ)所示。则甲条件可能是________,乙条件可能是________(填入下列条件的序号)。
①恒容条件下,升高温度
②恒容条件下,降低温度
③恒温条件下,缩小反应容器体积
④恒温条件下,扩大反应容器体积
⑤恒温恒容条件下,加入适当催化剂
【答案】0.02mol/L ③⑤ ④
【解析】
(1)混合气体总的物质的量不变,根据平衡时HI的体积分数计算![]() ,根据方程式知道转化的碘的物质的量,进而计算平衡时碘的物质的量,再根据
,根据方程式知道转化的碘的物质的量,进而计算平衡时碘的物质的量,再根据![]() 计算;
计算;
(2)由图可知,改变条件平衡不移动,甲的速率增大、乙的速率降低,据此结合外界条件对反应速率与平衡移动的影响判断。
混合气体总的物质的量不变,平衡时,![]() 由方程式可以知道,转化的碘的物质的量=
由方程式可以知道,转化的碘的物质的量=![]() ,平衡时碘的物质的量=1mol-0.9mol=0.1mol,平衡时,I2(g)的物质的量浓度为
,平衡时碘的物质的量=1mol-0.9mol=0.1mol,平衡时,I2(g)的物质的量浓度为![]() ,故答案为:0.02mol/L。
,故答案为:0.02mol/L。
(2)由图可以知道,改变条件平衡不移动,甲的速率增大、乙的速率降低,
①恒容条件下,升高温度,平衡向逆反应移动,
②恒容条件下,降低温度,平衡向正反应方向移动,
③恒温条件下,缩小反应容器体积,压强增大,平衡不移动,反应速率增大,
④恒温条件下,扩大反应容器体积,压强减小,平衡不移动,反应速率减小,
⑤恒温恒容条件下,加入适当催化剂,平衡不移动,反应速率增大,
故甲条件可能是③⑤,乙条件可能是④,故答案为:③⑤;④。

【题目】温度为T时,向2.0 L恒容密闭容器中充入1.0 mol PCl5,反应PCl5(g)===PCl3(g)+Cl2(g)经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
t/s | 0 | 50 | 150 | 250 | 350 |
n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
下列说法正确的是
A. 反应在前50 s的平均速率v(PCl3)=0.0032 mol·L-1·s-1
B. 保持其他条件不变,升高温度,平衡时c(PCl3)=0.11 mol·L-1,则反应的ΔH<0
C. 相同温度下,起始时向容器中充入1.0 mol PCl5、0.20 mol PCl3和0.20 mol Cl2,反应达到平衡前v(正)>v(逆)
D. 相同温度下,起始时向容器中充入2.0 mol PCl3和2.0 mol Cl2,达到平衡时,PCl3的转化率小于80%
【题目】已知293K时下列物质的溶度积![]() 单位已省略
单位已省略![]() :
:
| Ag2SO4 | FeS | CuS | Ag2S |
| 1.2×10-5 | 6.3×10-18 | 8.5×10-45 | 6.3×10-50 |
下列说法正确的是![]()
![]()
A.相同温度下,Ag2SO4、FeS、CuS饱和溶液中:![]()
B.向FeS悬浊液中滴加CuSO4溶液发生反应的离子方程式:![]()
C.浓度均为0.004mol/L的AgNO3和H2SO4溶液等体积混合后不能产生沉淀
D.向饱和Ag2S溶液中加少量Na2S固体,溶液中c(Ag+)不变