题目内容
【题目】安全气囊是行车安全的重要设施,当车辆发生碰撞的瞬间,安全装置通电点火使其中的粉末分解释放出大量的氮气形成气囊,从而保护司机及乘客的安全。为研究安全气囊工作的化学原理,取安全装置中的粉末进行研究。经实验分析,确定该粉末是一种混合物且只含Na、Fe、N、O四种元素。
(1)氧元素在元素周期表中的位置是__________,Na原子的结构示意图为__________,Na、Fe、N、O四种元素中三种主族元素的离子半径从大到小的顺序是__________(用离子符号表示)。
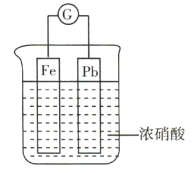
(2)水溶性实验表明,安全装置中固体粉末部分溶解。不溶物为一种红棕色固体,可溶于盐酸。已知该不溶物能发生铝热反应,写出该反应的化学方程式:___________。
(3)氮的最高价氧化物对应的水化物与其氢化物反应生成一种盐,该盐中含有的化学键类型是_____________。
【答案】第2周期第ⅥA族 
![]()
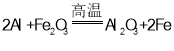 离子键、共价键
离子键、共价键
【解析】
(1)氧原子有2个电子层,最外层电子数为6,处于周期表中第2周期第ⅥA族;Na元素原子核外有11个电子,有3个电子层,从里到外各层电子数依次为2、8、1,原子结构示意图为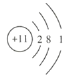 ;Na、Fe、N、O中Na、N、O是主族元素,
;Na、Fe、N、O中Na、N、O是主族元素,![]() 的电子层结构相同,核电荷数越大,离子半径越小,故离子半径:
的电子层结构相同,核电荷数越大,离子半径越小,故离子半径:![]() ;
;
(2)不溶物为一种红棕色固体,可溶于盐酸,且该不溶物能发生铝热反应,则红棕色不溶物为氧化铁,氧化铁与铝发生铝热反应生成氧化铝与铁,反应的化学方程式为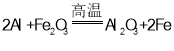 ;
;
(3)氮的最高价氧化物对应的水化物与其氢化物反应生成一种盐,该盐为![]() ,其中含有离子键、共价键。
,其中含有离子键、共价键。

 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案【题目】常温下,将一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
实验编号 | c(HA)/mol·L-1 | c(NaOH)/ mol·L-1 | 混合溶液的pH |
甲 | 0.1 | 0.1 | pH=a |
乙 | 0.2 | 0.2 | pH=9 |
丙 | c1 | 0.2 | pH=7 |
丁 | 0.2 | 0.1 | pH<7 |
下列判断正确的是
A. a>9B. 在乙组混合液中由水电离出的c(OH-)=10-5 mol·L-1
C. c1=0.2D. 丁组混合液中:c(Na+)>c(A-)>c(H+)>c(OH-)
【题目】一定条件下,可逆反应2A(g)![]() B(g)+3C(g),反应处于平衡状态的是( )
B(g)+3C(g),反应处于平衡状态的是( )
选项 | 正反应速率 | 逆反应速率 |
A | v(A)=2mol·L-1·min-1 | v(B)=2mol·L-1·min-1 |
B | v(A)=2mol·L-1·min-1 | v(C)=2mol·L-1·min-1 |
C | v(A)=1mol·L-1·min-1 | v(B)=2mol·L-1·min-1 |
D | v(A)=1mol·L-1·min-1 | v(C)=1.5mol·L-1·min-1 |
A.AB.BC.CD.D