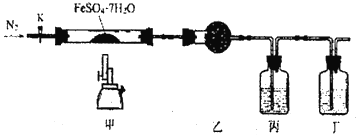
题目内容
【题目】兰尼镍是一种带有多孔结构的细小晶粒组成的镍铝合金,被广泛用作有机物的氢化反应的催化剂。以红土镍矿(主要成分为NiS、FeS和SiO2等)为原料制备兰尼镍的工艺流程如下图所示:
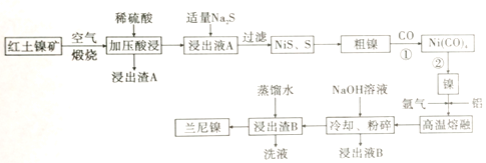
(1)煅烧时生成的主要气体产物是________ ,浸出渣A的主要成分是________。
(2)红土镍矿煅烧后生成的Ni2O3有强氧化性,加压酸浸时有无色无味的气体产生且有NiSO4生成,则该反应中氧化产物与还原产物的物质的量之比为________。
(3)向浸出液A中加入适量Na2S,发生氧化还原反应的离子方程式为________。
(4)若Na2S过量,则过滤出的固体中会混有________;H2S也可代替Na2S使用,但不利之处是________。
(5)已知Ni(CO)4的沸点是42.2℃,Ni(s)+CO(g) ![]() Ni(CO)4(g)的平衡常数与温度关系如下:
Ni(CO)4(g)的平衡常数与温度关系如下:
温度/℃ | 25 | 80 | 230 |
平衡常数 | 5×104 | 2 | 1.9×10-5 |
步骤①、步骤②的最佳温度分别是________、 ________(选填项代号)。
A.25℃ B.30℃ C.50℃ D.80℃ E.230℃
(6)加氢氧化钠的目的是溶解部分铝,形成多孔结构的镍铝合金,已知红土镍矿中NiS质量分数45.5%,取1kg红土镍矿进行制备,熔融时加入270g铝,浸出时消耗800mL 5mol/LNaOH,理论上生成的兰尼镍的化学式为________。
【答案】SO2; SiO2 1:4 2Fe3++S2-=2Fe2++S↓ FeS H2S有毒,污染坏境 C E Ni5Al6
【解析】
红土镍矿(主 要成分为NiS、FeS和SiO2等)煅烧发生氧化还原反应得到Ni2O3、Fe2O3 (SiO2不反应),加入硫酸加压酸浸,Ni2O3、Fe2O3溶解, 发生的反应有2Ni2O3+4H2SO4=4NiSO4+O2↑+4H2O、Fe2O3+3H2SO4=Fe2(SO4) 3+3H2O,SiO2不与硫酸反应,过滤得到浸出渣A (SiO2) ,浸出液A中含Ni2+、Fe3+,向浸出液A中通入Na2S,发生还原反应的 离子方程式是:2Fe3++S2-=2Fe2++S↓,另外生成沉淀NiS,过滤得到镍硫化合物NiS,再通入CO气体,形成Ni (CO) 4,加热得到镍,高温熔融时通入氩气,加入铝,得到合金,将合金冷却、粉碎,再用浓氢氧化钠溶液碱浸,铝与氢氧化钠反应产生氢气使镍铝合金产生多孔的结构,浸出液B中含偏铝酸根,最后用蒸馏水洗浸出渣B,得到产品兰尼镍,据此分析解答。
(1)由于矿物中含有硫元素,因此煅烧过程中产生的主要气体产物为SO2;矿物中的SiO2与稀硫酸不反应,因此所得滤渣A为SiO2;
(2)反应产生的无色无味的气体应为O2 ,该反应的化学方程式为:2Ni2O3+4H2SO4=4NiSO4+O2↑+4H2O;该反应中,氧化产物为O2 ,还原产物为NiSO4 ,二者的物质的量之比为1:4;
(3)滤液A中含有Fe3+ ,具有氧化性,能将S2-氧化成S,该反应的离子方程式为:2Fe3++S2-=2Fe2++S↓;
(4)若Na2S过量,则会与反应生成的Fe2+形成FeS沉淀;由于H2S是一种有毒气体,会造成空气污染,因此不用H2S代替Na2S;
(5)步骤①要制得Ni(CO)4 ,而Ni(CO)4的沸点为42.2℃,因此步骤①应选用温度为42.2℃左右,故选C;
步骤②要得到Ni,应使平衡逆向进行,结合温度对平衡常数的影响可知,应控制温度为230℃,故选E;
(6)1kg红土镍矿中所含Ni的质量![]() 浸出时发生反应的化学方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑,因此浸出时消耗n(Al)=n(NaOH)=5mol/L×0.8L=4mol,则形成兰尼镍的Al的质量m(Al)=270g-4mol×27g/mol=162g,令兰尼镍的化学式为NiaAlb ,由元素质量比可得等式
浸出时发生反应的化学方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑,因此浸出时消耗n(Al)=n(NaOH)=5mol/L×0.8L=4mol,则形成兰尼镍的Al的质量m(Al)=270g-4mol×27g/mol=162g,令兰尼镍的化学式为NiaAlb ,由元素质量比可得等式![]() ,解得
,解得![]() ,因此兰尼镍的化学式为Ni5Al6。
,因此兰尼镍的化学式为Ni5Al6。

【题目】运用化学反应原理研究氮、硫单质及其化合物性质是一个重要的课题。回答下列问题:
(1)恒容密闭容器中,工业固氮:N2(g)+3H2(g) ![]() 2NH3(g)的平衡常数K值和温度关系如表:
2NH3(g)的平衡常数K值和温度关系如表:
温度/℃ | 25 | 200 | 300 | 400 | 450 |
K | 5108 | 1.0 | 0.86 | 0.507 | 0.152 |
①从上表列出数据分析,该反应为__________反应(填:“吸热”或“放热”)。
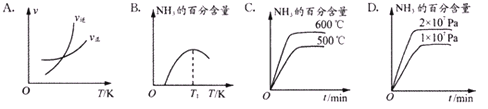
②有关工业合成氨的研究成果,曾于1918年、1931年、2007年三次荣膺诺贝尔奖。下列关于关于合成氨反应描述的图像中,不正确的是_________(填:字母选项)。
③450℃时,测得某时刻氨气、氮气、氢气物质的量浓度分别为3mol/L、2mol/L、1mol/L时,该反应的v(正)____________v(逆)(填“>”、“=”或“<”)。
(2)近年,科学家又提出在常温、常压、催化剂等条件下合成氨气的新思路,反应原理为:2N2(g)+6H2O(1)![]() 4NH3(g)+3O2(g),则其反应热ΔH=___________________。(已知:N2(g)+3H2(g)
4NH3(g)+3O2(g),则其反应热ΔH=___________________。(已知:N2(g)+3H2(g)![]() 2NH3(g) △H=-92.4kJ·mol-1 2H2(g) +O2(g)
2NH3(g) △H=-92.4kJ·mol-1 2H2(g) +O2(g)![]() 2H2O(l) △H=-571.6kJ·mol-1 )
2H2O(l) △H=-571.6kJ·mol-1 )
(3)联氨(N2H4)、二氧化氮(NO2)可与KOH溶液构成碱性燃料电池,其电池反应原理为2N2H4 +2NO2 = 3N2+8H2O。则负极的电极反应式为__________________________。
(4)部分金属硫化物的溶度积常数(Ksp)如下表:
硫化物 | CuS | ZnS | MnS | FeS |
Ksp | 6.3×10-36 | 2.9×10-25 | 2.5×10-13 | 6.3×10-18 |
由列表数据分析推知,向含有Cu2+、Zn2+、Mn2+、Fe2+的工业废水中加入MnS粉末的作用是_____________________________________。
(5)工业上从废铅蓄电池废液回收铅的过程中,常用纯碱溶液与处理后的铅膏(主要含PbSO4)发生反应:PbSO4(s)+CO32-(aq)![]() PbCO3(s)+SO42-(aq)。已知溶度积常数:Ksp(PbSO4)=1.6×10-8,Ksp(PbCO3)=7.4×10-14,则该反应的化学平衡常数K =_______。
PbCO3(s)+SO42-(aq)。已知溶度积常数:Ksp(PbSO4)=1.6×10-8,Ksp(PbCO3)=7.4×10-14,则该反应的化学平衡常数K =_______。