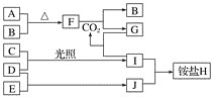
题目内容
【题目】有A、B、C、D、E、F6种短周期元素,G为过渡元素;已知相邻的A、B、C、D 4种元素原子核外共有56个电子,在周期表中的位置如图所示。1molE单质与足量酸作用,在标准状况下能产生33.6LH2;E单质粉末与G的氧化物常用于野外焊接钢轨;F是短周期最活泼的金属元素。请回答下列问题:
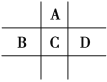
(1)元素D、G的名称分别为:__。
(2)D的单质与C的气态氢化物反应方程式为___。
(3)C、E、A的简单离子半径:__>__>__,B、C、D的最高价氧化物对应的水化物的酸性强弱顺序为___(用化学式表示)。
(4)向D与E形成的化合物的水溶液中滴加过量烧碱溶液的离子方程式为__。
(5)用电子式表示F与C形成化合物的过程___。
(6)G的单质与高温水蒸气反应的方程式___。
(7)部分元素在周期表中的分布如图所示(虚线为金属元素与非金属元素的分界线),下列说法不正确的是___。
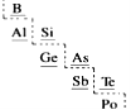
A.B只能得电子,不能失电子 B.原子半径Ge>Si
C.As可作半导体材料 D.Po处于第六周期第VIA族
【答案】氯 铁 Cl2+H2S=2HCl+S↓ S2- O2- Al3+ HClO4>H2SO4>H3PO4 Al3++4OH-=AlO2-+2H2O ![]() 3Fe+4H2O
3Fe+4H2O![]() Fe3O4+4H2 A
Fe3O4+4H2 A
【解析】
设C的原子序数为x,则A为x-8,B为x-1,C为x+1,A、B、C、D四种元素原子核外共有56个电子,则有x+x-8+x-1+x+1=56,x=16,所以C为S元素,A为O元素,B为P元素,D为Cl元素,1molE单质与足量酸作用,在标准状况下能产生33.6LH2,可知E的化合价为+3价,应为Al元素,E单质粉末与G的氧化物常用于野外焊接钢轨,G为Fe,F是短周期最活泼的金属元素,F为Na,根据元素周期律的递变规律比较原子半径以及元素的非金属性强弱,结合元素对应的单质、化合物的性质解答该题。
(1)根据分析,元素D为氯,元素G为铁。
(2)D的单质与C的气态氢化物反应即氯气与硫化氢反应,生成氯化氢和硫单质,反应方程式为Cl2+H2S=2HCl+S↓。
(3)根据电子层数越多,半径越大,具有相同结构的离子,原子序数越小的离子半径越大,则离子半径为S2->O2->Al3+;元素的非金属性越强,对应的最高价氧化物对应水化物的酸性越强,则有HClO4>H2SO4>H3PO4。
(4)D和E形成的化合物为AlCl3,水溶液中滴入过量烧碱溶液生成偏铝酸钠和水,离子反应为Al3++4OH--=AlO2-+2H2O。
(5)钠和氯在形成氯化钠的过程中,钠原子失去一个电子形成钠离子,氯原子得到一个电子形成氯离子,之后结合生成氯化钠,电子式表示为![]()
(6)G为铁,铁单质与高温水蒸气反应生成四氧化三铁和氢气,反应方程式为3Fe+4H2O![]() Fe3O4+4H2。
Fe3O4+4H2。
(7)A.B可以失电子,H3BO3中B显+3价,故A选项错误。
B.同一主族越往下原子半径越大,故原子半径Ge>Si,B选项正确。
C.As与Si化学性质较相近,也可作半导体材料,故C选项正确。
D.Po在周期表中处于第六周期第VIA族,故D选项正确。
故答案选A

 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案【题目】已知反应X(g)+Y(g)![]() R(g)+Q(g)的平衡常数与温度的关系如表所示。830 ℃时,向一个2 L的密闭容器中充入0.2 mol X和0.8 mol Y,反应初始4 s内v(X)=0.005 mol/(L·s)。下列说法正确的是
R(g)+Q(g)的平衡常数与温度的关系如表所示。830 ℃时,向一个2 L的密闭容器中充入0.2 mol X和0.8 mol Y,反应初始4 s内v(X)=0.005 mol/(L·s)。下列说法正确的是
温度/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
A. 4 s时容器内c(Y)=0.76 mol/L
B. 830 ℃达平衡时,X的转化率为80%
C. 反应达平衡后,升高温度,平衡正向移动
D. 1 200 ℃时反应R(g)+Q(g) ![]() X(g)+Y(g)的平衡常数K=0.4
X(g)+Y(g)的平衡常数K=0.4
【题目】元素周期表是学习化学的重要工具,它隐含着许多信息和规律。下表所列是五种短周期元素的原子半径及主要化合价(已知铍的原子半径为0.089 nm)。
元素代号 | A | B | C | D | E |
原子半径/nm | 0.16 | 0.143 | 0.102 | 0.099 | 0.074 |
主要化合价 | +2 | +3 | +6、-2 | -1 | -2 |
(1)用元素代号标出它们在周期表中所对应的位置(以下为周期表的一部分)_________。
(2)画出A的原子结构示意图_________。
(3)B元素处于周期表中第________周期,________族。
(4)E元素处于周期表中第________周期,________族。
(5)C、D的简单离子的半径由大到小顺序为________(用离子符号表示)。
(6)上述五种元素的最高价氧化物对应的水化物中酸性最强的是__________(填化学式)。
(7)C、E形成的化合物为________(填化学式)。
(8)写出B单质和氢氧化钠溶液反应的方程式__________写出B的最高价氧化物对应水化物和氢氧化钠溶液反应的离子方程式:________