题目内容
【题目】有关物质的转化关系如图所示(部分物质和条件已略去)。A、B、E、G、H、J常温下为气体,A为黄绿色,J为红棕色,B能使湿润的红色石蕊试纸变蓝,E是空气中含量最多的气体,C工业上用于制取漂白粉,K为一种红色金属单质,I是常见的无色液体。
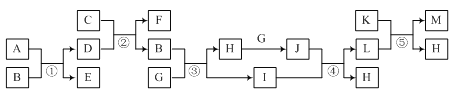
(1)E的化学式为___。
(2)反应②的化学方程式为___。
(3)写出反应③的化学方程式,并用单线桥表示电子转移的方向和数目:___。
(4)反应⑤的离子方程式为___。
【答案】N2 Ca(OH)2+2NH4Cl![]() CaCl2+2NH3↑+2H2O
CaCl2+2NH3↑+2H2O 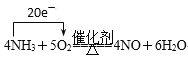 3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
【解析】
A为黄绿色的氯气,B能使湿润的红色石蕊试纸变蓝,则B为氨气,E是空气中含量最多的气体氮气,C工业上用于制取漂白粉为氢氧化钙,反应①为氯气和过量氨气的反应,其产物为氯化铵和氮气,反应②为氯化铵固体和氢氧化钙共热在实验室制氨气,从氨气到红棕色的气体J,只能是反应③中氨气被催化氧化成NO后进一步被氧化成红棕色的二氧化氮气体,J为二氧化氮,I为水,反应④为二氧化氮被水吸收生成硝酸和NO,K为一种红色金属单质铜,反应⑤是铜和稀硝酸反应,综上所述,A为氯气、B为氨气、C为氢氧化钙、D为氯化铵、E为氮气、F为氯化钙、G为氧气、H为一氧化氮、I为水、J为二氧化氮、K为铜、L为硝酸,M为硝酸铜,据此回答;
(1)E为氮气,化学式为N2;
(2)反应②为氯化铵固体和氢氧化钙共热在实验室制氨气:Ca(OH)2+2NH4Cl ![]() CaCl2+2NH3↑+2H2O;
CaCl2+2NH3↑+2H2O;
(3)反应③为氨的催化氧化生成NO和水;用单线桥表示电子转移的方向和数目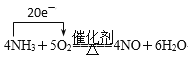 ;
;
(4)反应⑤是铜和稀硝酸反应;3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O。

 一线名师提优试卷系列答案
一线名师提优试卷系列答案【题目】磁性材料产业是21世纪各国竞相发展的高科技支柱产业之一,磁性材料广泛用于电子信息、军事技术等领域。碳酸锰主要用于制备软磁铁氧体,工业上用氯化铵焙烧锰矿粉制备高纯度碳酸锰的工艺流程如下:
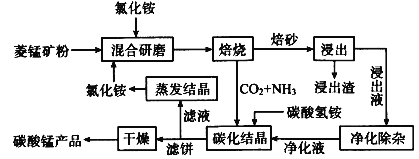
已知:①锰矿粉的主要成分是MnCO3,还含少量Fe、Al、Ca、Mg等元素。
②相关金属Mn+离子c(Mn+)=0.1molL -1形成M(OH)n沉淀的pH范围如下:
金属离子 | Fe3+ | Al3+ | Fe2+ | Mg2+ | Ca2+ | Mn2+ |
开始沉淀的pH | 1.5 | 3.8 | 6.3 | 9.6 | 10.6 | 8.8 |
沉淀完全的pH | 2.8 | 5.2 | 8.3 | 11.6 | 12.6 | 10.8 |
回答下列问题:
(1)“焙烧”时发生的主要反应的化学方程式为___。
(2)浸出液“净化除杂”过程如下:①加入MnO2将Fe2+氧化为Fe3+;②__将Al3+、Fe3+变为沉淀除去;③加入NH4F将__离子沉淀除去。写出反应①的离子方程式为___;
(3)碳化结晶时,反应的离子方程式为___。
(4)碳化结晶过程中不能用碳酸铵溶液代替碳酸氢铵溶液可能的原因是__。流程中能循环利用的物质除了氯化铵之外还有__。
(5)测定碳酸锰产品的纯度。
称取0.5000g碳酸锰产品于锥形瓶中,加25.00mL磷酸,加热,碳酸锰全部转化为[Mn(PO4)2]3-,冷却至室温。加水稀释至100mL,滴加2~3滴指示剂,然后用浓度为0.2000mol·L-1的硫酸亚铁铵[(NH4)2Fe(SO4)2]标准溶液滴定(反应为:[Mn(PO4)2]3- +Fe2+=Mn2+ +Fe3++2PO43-)。重复操作3次,记录数据如下表:
滴定次数 | 0.2000mol·L-1的硫酸亚铁铵标准溶液读数(mL) | |
滴定前 | 滴定后 | |
1 | 0.10 | 20.20 |
2 | 1.32 | 21.32 |
3 | 1.05 | 20.95 |
则产品的纯度=__,若滴定终点时发现滴定管尖嘴处产生了气泡,则测得的碳酸锰粗产品的纯度__(填“偏高”“偏低”或“无影响”)。