题目内容
16.取3.1克某有机物,加热蒸发,测得气体的体积为1.12L(已换算为标准状况),将其完全燃烧,并将燃烧后的产物先通入浓硫酸,然后在通入足量澄清石灰水,浓硫酸增重2.7克,石灰水中产生10.0克沉淀;求:
(1)该有机物的相对分子质量
(2)该有机物的分子式
(3)另取3.1克该有机物与足量的钠完全反应,放出氢气的体积为1.12L(已换算成标准状态),请确定该有机物的结构简式.
分析 (1)根据n=$\frac{V}{{V}_{m}}$计算出该有机物的物质的量,再根据M=$\frac{m}{n}$计算出该有机物的摩尔质量,从而得出其相对分子质量;
(2)浓硫酸增重的为水的质量,石灰水中生成的沉淀为碳酸钙,根据质量守恒定律确定该有机物的分子式;
(3)根据n=$\frac{V}{{V}_{m}}$计算出生成氢气的物质的量,再根据该有机物的物质的量确定其含有的官能团,然后确定其结构简式.
解答 解:(1)标况下1.12L该气体的物质的量为:$\frac{1.12L}{22.4L/mol}$=0.05mol,该气体的摩尔质量为:M=$\frac{3.1g}{0.05mol}$=62g/mol,
所以该有机物的分析分子质量为62,
答:该有机物的相对分子质量为62;
(2)浓硫酸增重的为水的质量,2.7g水的物质的量为:$\frac{2.7g}{18g/mol}$=0.15mol,0.05mol该有机物中含有氢原子的物质的量为:0.15mol×2=0.3mol,该源文件分子中含有H原子数为:$\frac{0.3mol}{0.05mol}$=6,
石灰水中生成的沉淀为碳酸钙,10.0g碳酸钙的物质的量为:$\frac{10.0g}{100g/mol}$=0.1mol,根据碳原子守恒,该有机物分子中含有C原子数为:$\frac{0.1mol}{0.05mol}$=2,
该有机物分子中含有C、H原子的总原子量为:12×2+1×6=30<62,说明该有机物分子中含有氧元素,含有氧元素的数目为:$\frac{62-30}{16}$=2,
所以该有机物的分子式为:C2H6O2,
答:该有机物的分子式为C2H6O2;
(3)标况下1.12L氢气的物质的量为:$\frac{1.12L}{22.4L/mol}$=0.05mol,3.1g该有机物的物质的量为0.05mol,
说明1mol该有机物生成了1mol氢气,
所以该有机物分子中含有2个羟基,
该有机物为乙二醇,其结构简式为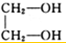 ,
,
答:该有机物的结构简式为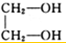 .
.
点评 本题考查了有机物分子式、结构简式的确定,题目难度中等,熟练掌握常见有机物结构与性质为解答关键,注意质量守恒定律在确定有机物分子式中的应用方法.

| A. | P既是氧化剂又是还原剂,CuSO4只是还原剂 | |
| B. | 若有11molP参加反应,转移电子的物质的量为60mol | |
| C. | 1molCuSO4可以氧化$\frac{1}{5}$molP | |
| D. | Cu3P既是氧化产物又是还原产物 |
| A. | 淀粉和纤维素互为同分异构体 | |
| B. | 糖类、油脂和蛋白质是基本营养物质,它们都是天然高分子化合物 | |
| C. | 可以用溴水鉴别苯、CCl4和无水乙醇 | |
| D. | 苯可以发生取代反应和加成反应,但是无法发生氧化反应 |
| A. | 1 L 0.1 mol/L Na2CO3溶液中,阴离子总数大于0.1 NA | |
| B. | 常温常压下,1 mol甘氨酸中含C-H键数目为3 NA | |
| C. | 标准状况下,6.72 L NO2与水充分反应转移的电子数目为0.1 NA | |
| D. | 50℃时,10 L pH=13的NaOH溶液中含有的OH-数目为NA |
| 选项 | 物质或离子 | 能否共存 | 原因解释 |
| A | 常温常压下:NH3、O3、H2、HCl | 不能共存 | NH3为碱性气体,HCl为酸性气体,发生的反应为:NH3+HCl=NH4Cl |
| B | 水溶液中:K+、Ag+、NO3-、NH3•H2O | 不能共存 | 发生反应的离子方程式为:Ag++OH-=AgOH↓ |
| C | 水电离出的c(OH-)=1×10-13mol/L的溶液中:Fe2+、MnO4-、SO42-、Na+ | 不能共存 | 只可能发生反应:Fe2++2OH-=Fe(OH)2↓ |
| D | 溶液中:Al3+、Na+、SO42-、CO32- | 可以共存 | 不能发生反应 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 二氧化硫使纸浆变白 | B. | 氯水使有色布条褪色 | ||
| C. | 活性炭使红墨水褪色 | D. | 漂白粉使某些染料褪色 |
| A. | 推广使用聚二氧化碳可降解塑料,能减少白色污染 | |
| B. | 通常所说的三大有机合成材料.合成纤维、合成橡胶 | |
| C. | 夏天雷雨过后感觉到空气清新是因为空气中产生了少量的二氧化氮 | |
| D. | 实施“煤改气”“煤改电”等清洁燃料改造工程,有利于保护环境 |
| A. |  装置:石油的分馏 | |
| B. |  装置:测定中和热 | |
| C. | 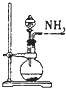 装置:将浓氨水滴加到生石灰中制取氨气 | |
| D. |  装置:加热氯化铵和消石灰混合物,制取并收集氨气 |
 ”,当
”,当