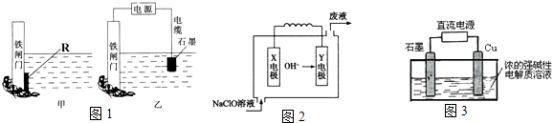
题目内容
【题目】某化学兴趣小组设计如下方案测定饱和食盐水的电解率.
[提示:饱和食盐水的电解率=(电解的氯化钠质量/总的氯化钠质量)×100%]
(1)方案一:连接图甲、乙装置,在洗气瓶a中盛放足量的氢氧化钠溶液,通过测定洗气瓶a在电解前后的质量变化来计算饱和食盐水的电解率. 
正确的连接顺序为导管口(填“A”或“B”)连导管口C,若事先往甲装置的饱和食盐水中滴入酚酞,则电解过程甲装置中(填“铁棒”或“碳棒”)附近的溶液变红.
(2)电解饱和食盐水总反应的化学方程式为 .
(3)方案二:利用甲装置电解后的溶液,通过中和滴定来测定饱和食盐水的电解率.
部分实验过程如下:
①用(填“酸式滴定管”或“碱式滴定管”)量取10.00mL电解后的溶液,加入锥形瓶中;
②向锥形瓶中加入几滴酚酞试液,用0.2000molL﹣1标准盐酸滴定待测液,边滴边摇动锥形瓶,直到时停止滴定;
③该小组所测实验数据如表:
实验序号 | 盐酸体积(mL) |
第一组 | 19.90 |
第二组 | 24.70 |
第三组 | 20.10 |
第四组 | 20.00 |
未电解前饱和食盐水的物质的量浓度为5.4molL﹣1 , 经计算,求出该食盐水的电解率为
④下列操作,会导致实验结果偏低的是(填序号).
A.滴定时锥形瓶中液滴飞溅出来
B.滴定前读数时平视,终点读数时俯视
C.锥形瓶用蒸馏水洗净后没用待测液润洗
D.酸式滴定管尖端气泡没有排除,滴定后消失.
【答案】
(1)B;铁棒
(2)2NaCl+2H2O ![]() 2NaOH+H2↑+Cl2↑
2NaOH+H2↑+Cl2↑
(3)碱式滴定管;滴入最后一滴时,锥形瓶中溶液颜色由红色变无色,并保持半分钟不褪色;7.4%;AB
【解析】解:(1)洗气瓶a中盛放的为足量的氢氧化钠溶液,通过测定洗气瓶a在电解前后的质量变化来计算饱和食盐水的电解率,氢氧化钠溶液可以吸收氯气发生反应,电解池中B端为阳极生成氯气,装置B连C,甲装置图分析电解饱和食盐水,溶液中氯离子在阳极上失电子生成氯气,氢离子在阴极得到电子生成氢气,阴极附近氢氧根离子浓度增大,遇到酚酞溶液变红色,电解过程中甲装置中的实验现象为:碳棒上有气泡产生,铁棒附近溶液变红,
所以答案是:B;铁棒;(2)电解饱和食盐水,溶液中氯离子在阳极上失电子生成氯气,氢离子在阴极得到电子生成氢气,电解反应为:2NaCl+2H2O ![]() 2NaOH+H2↑+Cl2↑;所以答案是:2NaCl+2H2O
2NaOH+H2↑+Cl2↑;所以答案是:2NaCl+2H2O ![]() 2NaOH+H2↑+Cl2↑;(3)①电解氯化钠得到的是氢氧化钠溶液,应选择碱式滴定管量取10.00mL电解后的溶液,加入锥形瓶中,所以答案是:碱式滴定管;
2NaOH+H2↑+Cl2↑;(3)①电解氯化钠得到的是氢氧化钠溶液,应选择碱式滴定管量取10.00mL电解后的溶液,加入锥形瓶中,所以答案是:碱式滴定管;
②用盐酸滴定氢氧化钠溶液,加入酚酞作指示剂,滴入最后一滴时,锥形瓶中溶液颜色由红色变无色,并保持半分钟不褪色;所以答案是:滴入最后一滴时,锥形瓶中溶液颜色由红色变无色,并保持半分钟不褪色;
③2NaCl+2H2O ![]() 2NaOH+H2↑+Cl2↑,电解消耗盐酸的体积是:
2NaOH+H2↑+Cl2↑,电解消耗盐酸的体积是: ![]() mL=20.00mL,消耗盐酸的物质的量:0.02L×0.2mol/L=0.004mol,所以100mL电解液中,电解的氯化钠物质的量为0.004mol,质量=0.004mol×58.5g/mol=0.234g,10mL溶液氯化钠溶液中含有溶质氯化钠质量=5.4mol/L×0.01L×58.5g/mol=3.159g,电解率=
mL=20.00mL,消耗盐酸的物质的量:0.02L×0.2mol/L=0.004mol,所以100mL电解液中,电解的氯化钠物质的量为0.004mol,质量=0.004mol×58.5g/mol=0.234g,10mL溶液氯化钠溶液中含有溶质氯化钠质量=5.4mol/L×0.01L×58.5g/mol=3.159g,电解率= ![]() =7.4%;所以答案是:7.4%;
=7.4%;所以答案是:7.4%;
④A.滴定时锥形瓶中液滴飞溅出来,则待测液的量减小,所以消耗盐酸体积减小,结果偏低,故正确;
B.滴定前读数时平视,终点读数时俯视,则消耗盐酸体积减小,结果偏低,故正确;
C.锥形瓶用蒸馏水洗净后没用待测液润洗,不影响结果,故错误;
D.酸式滴定管尖端气泡没有排除,滴定后消失,消耗盐酸体积减小,结果偏高,故错误;
故选AB.

 作业辅导系列答案
作业辅导系列答案