题目内容
【题目】已知a、b、c、d、e、f都是周期表中前四周期的元素,它们的原子序数依次增大。其中a、c原子的L层有2个未成对电子,d与e同主族,d的二价阳离子与c的阴离子具有相同的电子层结构,f3+离子M层3d轨道电子为半充满状态。请根据以上信息,回答下列问题(答题时,用所对应的元素符号表示):
(1)画出f3+离子的价层电子排布图__________,bH3分子中b原子的价层电子对构型为__________。
(2)写出一种与ab-互为等电子体的分子的化学式_________,ab-中a原子的杂化方式为_______。
(3)f和m(质子数为25) 两元素的部分电离能数据列于下表:
元素 | m | f | |
电能(kJ·mol-1) | I1 | 717 | 759 |
I2 | 1509 | 1561 | |
I3 | 3248 | 2957 | |
比较两元素的I2、I3可知,气态m2+再失去一个电子比气态f2+再失去一个电子难,原因是____________。
(4)已知e的碳酸正盐热分解温度比d的高,其原因是___________________。
(5)已知CaF2晶体常用于助熔剂,其晶胞结构如图所示。
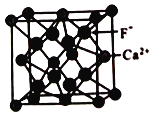
设阿伏加德罗常数的值为NA ,F原子和Ca原子之间的距离为apm,在晶胞体对角线的1/4、3/4两点分别有个F-,则Ca2+的配位数是_______,晶体的密度为_______。
【答案】 ![]() 四面体形 CO成N2 sp杂化 Mn2+的3d轨道电子排布为半充满状态较稳定 Mg2+半经比Ca2+小,MgO的晶格能比CaO大,MgCO3比CaCO3更易分解,因此CaCO3热分解温度较高 8
四面体形 CO成N2 sp杂化 Mn2+的3d轨道电子排布为半充满状态较稳定 Mg2+半经比Ca2+小,MgO的晶格能比CaO大,MgCO3比CaCO3更易分解,因此CaCO3热分解温度较高 8 ![]() ×1030g/cm3
×1030g/cm3
【解析】试题分析:a、c原子的L层有2个未成对电子,a是C元素、c是O元素、b是N元素;d的二价阳离子与![]() 具有相同的电子层结构,d是Mg元素; f3+离子M层3d轨道电子为半充满状态,f是Fe元素;d与e同主族,e是Ca元素;
具有相同的电子层结构,d是Mg元素; f3+离子M层3d轨道电子为半充满状态,f是Fe元素;d与e同主族,e是Ca元素;
解析:根据以上分析,(1)Fe3+3d轨道上的电子为价电子,Fe3+价层电子排布图是![]() ,NH3分子中N原子的价电子对数为
,NH3分子中N原子的价电子对数为![]() ,价层电子对构型为四面体形。(2)等电子体是原子数相同,价电子数相同的分子或离子,与CN-互为等电子体的分子的化学式CO或N2,CN-中C和N之间是叁键,C的σ键有2个,无孤电子对,价层电子对数为2,属于sp杂化。(3)f是Fe、m(质子数为25)是Mn,Mn2+的3d轨道电子排布为半充满状态较稳定,Fe2+的3d轨道有6个电子,所以气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难;(4)Mg2+半经比Ca2+小,MgO的晶格能比CaO大,MgCO3比CaCO3更易分解,因此CaCO3热分解温度较高; (5)在晶胞体对角线的1/4、3/4两点分别有个F-,则Ca2+的配位数是8;晶胞体对角线的1/4、3/4两点分别有个F-,所以1个晶胞含有8个F-;根据均摊原则,1个晶胞含有Ca2+=
,价层电子对构型为四面体形。(2)等电子体是原子数相同,价电子数相同的分子或离子,与CN-互为等电子体的分子的化学式CO或N2,CN-中C和N之间是叁键,C的σ键有2个,无孤电子对,价层电子对数为2,属于sp杂化。(3)f是Fe、m(质子数为25)是Mn,Mn2+的3d轨道电子排布为半充满状态较稳定,Fe2+的3d轨道有6个电子,所以气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难;(4)Mg2+半经比Ca2+小,MgO的晶格能比CaO大,MgCO3比CaCO3更易分解,因此CaCO3热分解温度较高; (5)在晶胞体对角线的1/4、3/4两点分别有个F-,则Ca2+的配位数是8;晶胞体对角线的1/4、3/4两点分别有个F-,所以1个晶胞含有8个F-;根据均摊原则,1个晶胞含有Ca2+=![]() ,所以晶胞的摩尔质量是312g/mol;F原子和Ca原子之间的距离为apm,则晶胞的边长是
,所以晶胞的摩尔质量是312g/mol;F原子和Ca原子之间的距离为apm,则晶胞的边长是![]() ,所以晶体的密度是
,所以晶体的密度是![]()
![]() ×1030g/cm3 。
×1030g/cm3 。

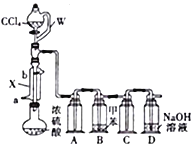
【题目】为探究 H2O2、SO2、Br2 氧化性强弱,某小组同学设计如下实验(夹持及尾气处理装置已略去,气密性已检验)
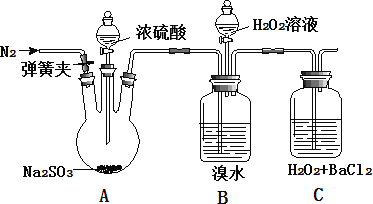
实验操作 | 实验现象 |
i. 打开 A 中分液漏斗活塞,滴加浓硫酸 | A 中有气泡产生,B 中红棕色褪色,C 中有白色沉淀 |
ii. 取 C 中沉淀加入盐酸 | C 中白色沉淀不溶解 |
iii. 打开B 中分液漏斗活塞,逐滴滴加H2O2 | 开始时颜色无明显变化;继续滴加 H2O2 溶液,一段时间后,混合液逐渐变成红棕色 |
(1)A 中发生反应的化学方程式是_____。
(2)B 中红棕色褪色的离子方程式是_____。
(3)甲同学通过 C 中产生白色沉淀,得出结论,氧化性:H2O2>SO2。C 中产生白色沉淀的离子方程式是_____。
①乙同学认为不能得出此结论, 认为在滴加浓硫酸之前应增加一步操作, 该操作是_____。
②丙同学认为还应该在 B 和 C 之间增加洗气瓶 D,D 中盛放的试剂是_____。
③将乙和丙同学改进后的方案进行实验,C 中产生白色沉淀,得出结论:氧化性 H2O2>SO2。
(4)iii 中滴入少量 H2O2 没有明显变化。提出假设:
观点 1:H2O2 的量少不能氧化溴离子
观点 2:B 中有未反应 SO2
为验证观点 2,应进行的实验操作及现象是_____。
(5)通过上述全部实验,得出结论:H2O2、SO2、Br2 氧化性由强到弱的顺序是_____。