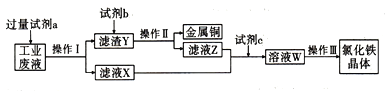
��Ŀ����
����Ŀ��COCl2(����)��һ����Ҫ���л��м��壬��ũҩ��ҽҩ���������ϡ��۰��������Լ������϶���������;�������£�����һ����ɫ���壬�о綾���е�Ϊ8.2�棬����ˮ�����ڷ���������CCl4���л��ܼ�����ˮѸ��ˮ�������Ȼ��⡣ʵ���ҿ������Ȼ�̼��Ũ��������ȡ����,��ʵ��װ����ͼ��ʾ���ش��������⣺
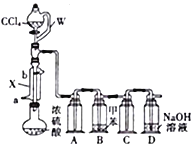
(1)����X��������________��ˮ��________(�a����b��)�ڽ��롣
(2)��Һ©�����β����뵼�ܲ�����W�����ӵ�Ŀ����____________________________��
(3)װ��A��C��������________��װ��D��������_____________________��Ϊȷ��ʵ�鰲ȫ,��ʵ��Ӧ��________(��ʵ����ʩ����)�н��С�
(4)�轫Բ����ƿ��Ũ���������120~130�棬Ϊ�˾������ȣ����˵ļ��ȷ�ʽ��________��Ȼ�������μ�CCl4�����ɲ�����������֪�μ�CCl4������ת��ΪS2O3Cl2����Բ����ƿ�з�����Ӧ�Ļ�ѧ����ʽΪ________________________��
(5)�����ĵ���ʽΪ________��ҽ���ϳ��õ����������ȼ���ɱ�������������Ϊ����,Ϊ��ֹ�����¹ʣ�ʹ�����ȼ���ǰ����������Ƿ����������˵ļ����Լ�Ϊ________��
���𰸡� (ֱ��)������ a ʹ��Һ©������ѹǿ���,����Һ��˳������ ����ȫƿ ����HCl��������COCl2 ͨ��� ��ԡ(��ɳԡ)���� 3CCl4+2H2SO4(Ũ) ![]() 3COCl2��+4HCl��+S2O3Cl2
3COCl2��+4HCl��+S2O3Cl2  AgNO3��Һ��ϡ����
AgNO3��Һ��ϡ����
��������(1)����X��������(ֱ��)�����ܣ�������ˮ���������½��ϳ�������Ǵ�a�ڽ�����(2)��Һ©�����β����뵼�ܲ�����W�����ӵ�Ŀ����ʹ��Һ©������ѹǿ���,����Һ��˳�����£�(3)װ��A��C������������ȫƿ����ֹװ�ù�����װ��B��Ѹ���ܽ���ɵ�ѹǿ���ٱ仯��������װ��D�������ǣ�����HCl��������COCl2��ֱֹ���ŷ���ɿ�����Ⱦ��Ϊȷ��ʵ�鰲ȫ,��ʵ��Ӧ��ͨ����н��У�(4) �轫Բ����ƿ��Ũ���������120~130�棬����100�治����ˮԡ���ȣ�Ϊ�˾������ȣ����˵ļ��ȷ�ʽ����ԡ���Ȼ�ɳԡ���ȣ� CCl4�����ᷴӦ����S2O3Cl2���������Ȼ��⣬��Ӧ�Ļ�ѧ����ʽΪ3CCl4+2H2SO4(Ũ) ![]() 3COCl2��+4HCl��+S2O3Cl2��(5)�����ĵ���ʽΪ
3COCl2��+4HCl��+S2O3Cl2��(5)�����ĵ���ʽΪ �����ȼ��鲻������������Ӧ��������ˮѸ��ˮ�������Ȼ��⣬����������Ӧ����������������Ȼ�����ɫ��������ʹ�����ȼ���ǰ����������Ƿ����������˵ļ����Լ�ΪAgNO3��Һ��ϡ���ᡣ
�����ȼ��鲻������������Ӧ��������ˮѸ��ˮ�������Ȼ��⣬����������Ӧ����������������Ȼ�����ɫ��������ʹ�����ȼ���ǰ����������Ƿ����������˵ļ����Լ�ΪAgNO3��Һ��ϡ���ᡣ

 ��ڽ��ȫ������ϵ�д�
��ڽ��ȫ������ϵ�д�����Ŀ����֪a��b��c��d��e��f�������ڱ���ǰ�����ڵ�Ԫ�أ����ǵ�ԭ������������������a��cԭ�ӵ�L����2��δ�ɶԵ��ӣ�d��eͬ����,d�Ķ�����������c�������Ӿ�����ͬ�ĵ��Ӳ�ṹ��f3+����M��3d�������Ϊ�����״̬�������������Ϣ���ش���������(����ʱ��������Ӧ��Ԫ�ط��ű�ʾ)��
��1������f3+���ӵļ۲�����Ų�ͼ__________��bH3������bԭ�ӵļ۲���ӶԹ���Ϊ__________��
��2��д��һ����ab-��Ϊ�ȵ�����ķ��ӵĻ�ѧʽ_________��ab-��aԭ�ӵ��ӻ���ʽΪ_______��
��3��f��m(������Ϊ25) ��Ԫ�صIJ��ֵ��������������±���
Ԫ�� | m | f | |
����(kJ��mol-1) | I1 | 717 | 759 |
I2 | 1509 | 1561 | |
I3 | 3248 | 2957 | |
�Ƚ���Ԫ�ص�I2��I3��֪����̬m2+��ʧȥһ�����ӱ���̬f2+��ʧȥһ�������ѣ�ԭ����____________��
��4����֪e��̼�������ȷֽ��¶ȱ�d�ĸߣ���ԭ����___________________��
��5����֪CaF2���峣�������ۼ����侧���ṹ��ͼ��ʾ��
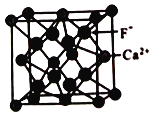
�谢���ӵ�������ֵΪNA ��Fԭ�Ӻ�Caԭ��֮��ľ���Ϊapm���ھ�����Խ��ߵ�1/4��3/4����ֱ��и�F-����Ca2+����λ����_______��������ܶ�Ϊ_______��
����Ŀ�������£�������������Һ��
�� | �� | �� | �� |
0.1mol/L ���� | pH = 3���� | 0.1mol/L ��ˮ | pH = 11��ˮ |
����˵����ȷ����
A. ��ˮ�������c(H+):�٣���
B. ��ϡ�͵�ԭ����100����pH������ͬ
C. ��������ϣ�����ҺpH = 7����V(����)��V(��ˮ)
D. ��������ϣ�����Һ�Լ��ԣ���������Һ������Ũ�ȿ���Ϊ��c(NH4+)��c(OH-)��c(Cl-)��c(H+)
���𰸡�D
�����������������A.��ͬŨ�ȵİ�ˮ�����ᣬ��ˮʵ���ϻ���ٽ�ˮ�ĵ��룬������ˮ���������c(H+):��������B.�������ǿ��Ļ���ϡ��100������pHһ��Ϊ11�����ǹؼ���ˮ���������ϡ�͵�ʲô�̶ȣ�������δ����İ�ˮ���ڣ�����pHһ����11ҪС��C.��������ϵõ������Ȼ�泥��Ȼ����ǿ�������Σ������ԣ���������Ҫ��pHΪ7����ˮ������һ��Ҫ�������������ſ��ԡ�D.������Һ�Լ��ԣ��������������ӵ�Ũ��һ��Ҫ�������ӵ�Ũ�ȴ���笠����ӵ�Ũ��Ҫ�������ӵ�Ũ�ȴ�
���㣺������������ʵĵ���ƽ�⡢����ˮ�⡢����Ũ�ȵĴ�С�Ƚϵ����֪ʶ��
�����͡���ѡ��
��������
18
����Ŀ��25��ʱ��������������ˮ��Һ�еĵ�����ƽ�ⳣ�����������ѡ����ȷ���ǣ�������
�����ᣨHCN�� | ̼�ᣨH2C03�� | ����ᣨHF�� |
K=4.9��10��10 | K1=4.4��10��7 K2=4.7��10��11 | K=6.61��10��4 |
A. �軯����Һ��ͨ������CO2��2CN��+H2O+CO2�T2HCN+CO32��
B. NaCN��HCN�Ļ����Һ��һ���У�c��Na+����c��CN������c��HCN����c��H+����c��OH-��
C. 25��ʱCN-��ˮ��ƽ�ⳣ��ԼΪ1.6��10-5
D. NaCN��HCN�Ļ����Һ�У�2c(Na+)=c(CN����+c(HCN)