题目内容
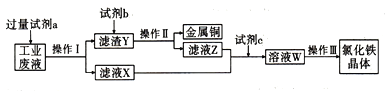
【题目】反应N2O4(g)![]() 2NO2(g)在温度为T1、T2(T2>T1)时,平衡体系中NO2的体积分数随压强变化如图所示。下列说法正确的是
2NO2(g)在温度为T1、T2(T2>T1)时,平衡体系中NO2的体积分数随压强变化如图所示。下列说法正确的是

A. 由图可知B点的平衡常数大于C点的平衡常数
B. A、C两点气体的颜色:A深,C浅
C. A、C两点气体的平均相对分子质量:A<C
D. 保持容器体积不变,再充入N2O2气体,平衡逆向移动
【答案】C
【解析】A.由图可知,相同压强下,T2>T1时,温度高对应的NO2体积分数大,则正反应为吸热反应,则B点的平衡常数小于C点的平衡常数,故A错误;B.A、C两点温度相同,由A点增大压强变成C点,NO2的浓度增大,二氧化氮为红棕色气体,则A浅、C深,故B错误;C.质量不变,C点对应压强大,压强增大,平衡逆向移动,气体的物质的量减小,由M=![]() 可知,则A、C两点气体的平均相对分子质量:A<C,故C正确;D.保持容器体积不变,再充入N2O4气体,反应物浓度增大,平衡正向移动,故D错误;故选C。
可知,则A、C两点气体的平均相对分子质量:A<C,故C正确;D.保持容器体积不变,再充入N2O4气体,反应物浓度增大,平衡正向移动,故D错误;故选C。

 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案【题目】已知a、b、c、d、e、f都是周期表中前四周期的元素,它们的原子序数依次增大。其中a、c原子的L层有2个未成对电子,d与e同主族,d的二价阳离子与c的阴离子具有相同的电子层结构,f3+离子M层3d轨道电子为半充满状态。请根据以上信息,回答下列问题(答题时,用所对应的元素符号表示):
(1)画出f3+离子的价层电子排布图__________,bH3分子中b原子的价层电子对构型为__________。
(2)写出一种与ab-互为等电子体的分子的化学式_________,ab-中a原子的杂化方式为_______。
(3)f和m(质子数为25) 两元素的部分电离能数据列于下表:
元素 | m | f | |
电能(kJ·mol-1) | I1 | 717 | 759 |
I2 | 1509 | 1561 | |
I3 | 3248 | 2957 | |
比较两元素的I2、I3可知,气态m2+再失去一个电子比气态f2+再失去一个电子难,原因是____________。
(4)已知e的碳酸正盐热分解温度比d的高,其原因是___________________。
(5)已知CaF2晶体常用于助熔剂,其晶胞结构如图所示。
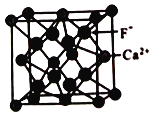
设阿伏加德罗常数的值为NA ,F原子和Ca原子之间的距离为apm,在晶胞体对角线的1/4、3/4两点分别有个F-,则Ca2+的配位数是_______,晶体的密度为_______。