题目内容
【题目】化学与生活、生产、科研密切相关,请根据所学知识回答:
物质在水中可能存在电离平衡、盐的水解平衡和沉淀的溶解平衡,它们都可看作化学平衡。
(1)A为0.1mol·L-1的(NH4)2SO4溶液,在该溶液中各种离子的浓度由大到小顺序为____。
(2)B为0.1mol·L-1NaHCO3溶液,实验测得NaHCO3溶液的pH>7,请分析NaHCO3溶液显碱性的原因:___。
(3)C为FeCl3溶液,实验室中配制FeCl3溶液时通常需要向其中加入___,目的是___;
(4)若把B和C溶液混合,将产生红褐色沉淀和无色气体,该反应的离子方程式为___。
【答案】c(NH4+)>c(SO42-)>c(H+)>c(OH-) 在碳酸氢钠溶液中水解程度大于电离程度,HCO3-+H2O![]() H2CO3+OH-水解显碱性 盐酸 抑制Fe3+水解 Fe3++3HCO3-=Fe(OH)3↓+3CO2↑
H2CO3+OH-水解显碱性 盐酸 抑制Fe3+水解 Fe3++3HCO3-=Fe(OH)3↓+3CO2↑
【解析】
(1)NH4+水解使溶液呈酸性,但水解程度微弱;
(2)测得NaHCO3溶液的pH>7,从弱酸的阴离子水解的角度分析;
(3)Fe3+易水解,离子方程式为:Fe3++3H2O![]() Fe(OH)3+3H+,实验室中配制FeCl3溶液时要防止Fe3+水解;
Fe(OH)3+3H+,实验室中配制FeCl3溶液时要防止Fe3+水解;
(4)把B和C溶液混合,Fe3+和HCO3-发生双水解,生成红褐色沉淀和无色气体。
(1)NH4+水解使溶液呈酸性,c(H+)>c(OH-),由于NH4+水解程度微弱,因此在该溶液中各种离子的浓度由大到小顺序为c(NH4+)>c(SO42-)>c(H+)>c(OH-);
(2)在碳酸氢钠溶液中水解程度大于电离程度,HCO3-水解方程式为HCO3-+H2O![]() H2CO3+OH-,HCO3-水解使溶液显弱碱性,溶液的pH>7;
H2CO3+OH-,HCO3-水解使溶液显弱碱性,溶液的pH>7;
(3)Fe3+易水解,离子方程式为:Fe3++3H2O![]() Fe(OH)3+3H+,实验室中配制FeCl3溶液时要防止Fe3+水解,因此配制FeCl3溶液时通常需要向其中加入盐酸;
Fe(OH)3+3H+,实验室中配制FeCl3溶液时要防止Fe3+水解,因此配制FeCl3溶液时通常需要向其中加入盐酸;
(4)把B和C溶液混合,Fe3+和HCO3-发生双水解,生成红褐色沉淀和无色气体,离子方程式为:Fe3++3HCO3-=Fe(OH)3↓+3CO2↑。

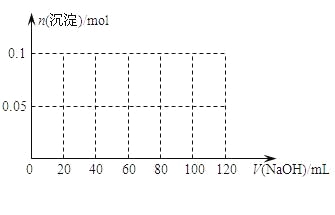
【题目】某混合溶液中,可能大量含有的离子如下表:
阳离子 | H+、K+、Al3+、NH |
阴离子 | OH-、SO42—、CO32—、AlO2— |
将Na2O2逐渐加入上述混合溶液中并微热,产生沉淀和气体如图所示。

下列说法不正确的是:
A. 上述混合溶液中一定大量含有H+、NH4+、Al3+、Mg2+、SO42—
B. 图中a=4
C. b=7;c=9
D. 此溶液还需要用焰色反应继续检验,才能确定溶液准确组成