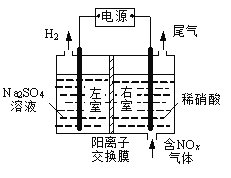
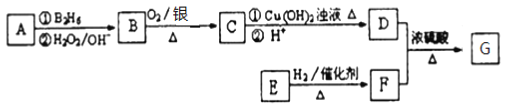
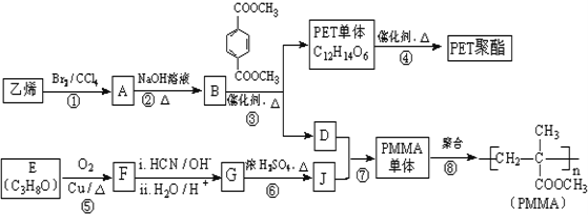
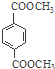
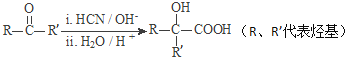题目内容
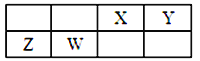
【题目】X、Y、Z、W为四种短周期元素,它们在周期表中位于连续的四个主族,如图所示。Z元素原子最外层电子数是内层电子总数的1/5。下列说法中正确的是
A. 原子半径由小到大的顺序为:X<Z<Y<W
B. Y元素最高价氧化物对应的水化物化学式为H3YO4
C. X、Z两种元素的氧化物中所含化学键类型相同
D. Y最简单气态氢化物比Y相邻周期同主族元素气态氢化物沸点高
【答案】D
【解析】试题分析:X、Y、Z、W为四种短周期元素,根据表知,它们处于第二、三周期,它们在周期表中位于连续的四个主族,Z元素原子最外层电子数是内层电子总数的1/5,且Z处于第三周期,所以Z是Mg元素,则W是Al元素,X是C元素,Y是N元素。A.电子层数越多,半径越大,同周期从左向右原子半径在减小,则原子半径为Y<X<W<Z,A项错误;B.Y为N元素,N元素处于第VA族,在其最高价含氧酸中显+5价,所以Y元素最高价氧化物对应的水化物化学式为HYO3,B项错误;C.X的氧化物为H2O、H2O2,Z的氧化物为Na2O、Na2O2,水和双氧水中只含有共价键,氧化钠和过氧化钠中只含有离子键,C项错误;
D.Y为N元素,简单气态氢化物为NH3,NH3分子中有分子间氢键,与Y相邻周期同主族元素的气态氢化物为PH3,PH3中不含氢键,所以Y的最简单气态氢化物比Y相邻周期同主族元素气态氢化物沸点高,D项正确;答案选D。

练习册系列答案
 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案
相关题目