题目内容
【题目】电解法处理含氮氧化物废气,可回收硝酸,具有较高的环境效益和经济效益。实验室模拟电解法吸收NOx的装置如右图所示(图中电极均为石墨电极)。
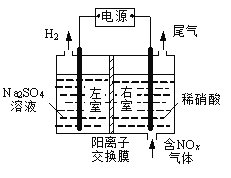
(1)若用NO2气体进行模拟电解法吸收实验。
①写出电解时NO2发生反应的电极反应式: 。
②若有标准状况下2.24 LNO2被吸收,通过阳离子交换膜(只允许阳离子通过)的H+为 mol。
(2)某小组在右室装有10 L 0.2 mol/L硝酸,用含NO和NO2(不考虑NO2转化为N2O4)的废气进行模拟电解法吸收实验。
①实验前,配制10 L 0.2mol/L硝酸溶液,需量取 mL的密度为1.4 g/mL、质量分数为63%的浓硝酸。
②电解过程中,有部分NO转化为HNO2。实验结束时,测得右室溶液中含3 molHNO3、0.1 molHNO2,同时左室收集到标准状况下28 L H2。计算原气体中NO和NO2的体积比(假设尾气中不含氮氧化物,写出计算过程)。
【答案】(1)①NO2-e-+H2O = NO+2H+ ②0.1;(2)①142.9;
②根据原子守恒: n(NO)+ n(NO2)=3 mol- 0.2 mol/L×10 L+0.1 mol =1.1 mol
根据电子守恒:0.1 mol×1+ [ n(NO)- 0.1 mol]×3+ n(NO2)×1= ![]() ×2
×2
解得:n(NO)= 0.8 mol n(NO2)= 0.3 mol
V(NO):V(NO2)= n(NO): n(NO2)= 0.8 mol: 0.3 mol=8:3
【解析】
试题分析:(1)①分析通过装置知该电解装置左室为电解池的阴极,电极反应式为2H2O + 2e-== H2↑ + 2OH-,右室为电解池的阳极,NO2气体发生氧化反应生成硝酸,电极反应式为NO2-e-+H2O = NO+2H+。
②根据阴、阳两极的电极反应式知若有标准状况下2.24 LNO2被吸收,转移电子0.1mol,阴极区生成的氢氧根为0.1mol,为维持电荷守恒通过阳离子交换膜的H+为0.1mol。
(2)①根据公式c=计算密度为1.4 g·mL-1、质量分数为63%的浓硝酸的物质的量浓度为1000×1.4 g·mL-1×63%/63 g·mol-1=14 mol/L。根据稀释定律c1V1=c2V2计算所需浓硝酸的体积为10 L ×0.2 mol·L-1/14 mol·L-1=0.1429L=142.9mL;
②根据题意知电解池的阴极电极反应式为2H2O + 2e-== H2↑ + 2OH-,电解池的阳极电极反应式为NO2-e-+H2O = NO+2H+、NO-e-+H2O = HNO2+H+ 、NO-3e-+2H2O = NO+4H+。根据原子守恒和电荷守恒作答。根据原子守恒:n(NO)+ n(NO2)=3 mol- 0.2 mol/L×10 L+0.1 mol =1.1 mol,根据电子守恒:0.1 mol×1+ [ n(NO)- 0.1 mol]×3+ n(NO2)×1= ![]() ×2,解得:n(NO)= 0.8 mol n(NO2)= 0.3 mol,V(NO):V(NO2)= n(NO): n(NO2)= 0.8 mol: 0.3 mol=8:3
×2,解得:n(NO)= 0.8 mol n(NO2)= 0.3 mol,V(NO):V(NO2)= n(NO): n(NO2)= 0.8 mol: 0.3 mol=8:3