题目内容
将0.3mol NaCl固体与0.1mol CuSO4?5H2O固体混合溶于水,配成1000mL混合液.然后取出200ml溶液,用石墨作电极,通电一段时间.电解过程分为三个阶段试回答:
(1)其中第一阶段发生的电解反应的离子方程式为
(2)电解的最后一个阶段,阴极上发生的电极反应式变为
(3)若Cl-正好全部变为氯气逸出时,阴极上产生气体的体积
(1)其中第一阶段发生的电解反应的离子方程式为
Cu2++2Cl- Cu+Cl2
Cu+Cl2
 Cu+Cl2
Cu+Cl2Cu2++2Cl- Cu+Cl2
Cu+Cl2
. Cu+Cl2
Cu+Cl2(2)电解的最后一个阶段,阴极上发生的电极反应式变为
2H++2e-═H2
2H++2e-═H2
.(3)若Cl-正好全部变为氯气逸出时,阴极上产生气体的体积
0.224L
0.224L
L(标准状况下)分析:(1)根据溶液中阴阳离子的放电顺序,判断每一阶段放电的离子,然后写出电解反应的离子方程式.
(2)先确定最后阶段放电的离子,再写出阴极上发生的电极反应式.
(3)先根据题意判断当阴极有气体产生时发生的电解反应,然后计算铜全部析出时剩余的氯离子的物质的量,根据氯离子的物质的量计算阴极上生成气体的体积.
(2)先确定最后阶段放电的离子,再写出阴极上发生的电极反应式.
(3)先根据题意判断当阴极有气体产生时发生的电解反应,然后计算铜全部析出时剩余的氯离子的物质的量,根据氯离子的物质的量计算阴极上生成气体的体积.
解答:解:根据题意知,取出的溶液中含有的溶质的物质的量分别为:NaCl0.06mol,CuSO40.02mol;溶液中阴阳离子的放电顺序分别为:阳离子放电顺序Cu2+>H+>Na+,阴离子放电顺序为Cl->OH->SO42-
所以,该溶液电解三个阶段分别为:
第一阶段:Cu2+和Cl-放电,生成氯气和铜;
根据得失电子相等知,铜离子先完全电解,氯离子还剩0.02mol,所以发生第二阶段电解反应;
第二阶段:H+ 和Cl-放电,生成氢气和氯气;
根据得失电子相等知,氯离子完全电解,发生第三阶段反应,
第三阶段:H+ 和OH-放电,生成氢气和氧气.
(1)根据以上分析知,第一阶段的电解反应为Cu2++2Cl-
Cu+Cl2
故答案为Cu2++2Cl-
Cu+Cl2
(2)电解的最后阶段,H+ 在阴极上放电,OH-的阳极上放电,分别生成氢气和氧气.
故答案为:2H++2e-═H2↑
(3)当铜离子全部生成铜单质时,根据得失电子相等知,氯离子还剩0.02mol.
当阴极上有气体生成时,发生的电解反应为:
2Cl-+2H2O
Cl2↑+H2↑+2OH-
2 22.4L
0.02mol 0.224L
故答案为 0.224L.
所以,该溶液电解三个阶段分别为:
第一阶段:Cu2+和Cl-放电,生成氯气和铜;
根据得失电子相等知,铜离子先完全电解,氯离子还剩0.02mol,所以发生第二阶段电解反应;
第二阶段:H+ 和Cl-放电,生成氢气和氯气;
根据得失电子相等知,氯离子完全电解,发生第三阶段反应,
第三阶段:H+ 和OH-放电,生成氢气和氧气.
(1)根据以上分析知,第一阶段的电解反应为Cu2++2Cl-
| ||
故答案为Cu2++2Cl-
| ||
(2)电解的最后阶段,H+ 在阴极上放电,OH-的阳极上放电,分别生成氢气和氧气.
故答案为:2H++2e-═H2↑
(3)当铜离子全部生成铜单质时,根据得失电子相等知,氯离子还剩0.02mol.
当阴极上有气体生成时,发生的电解反应为:
2Cl-+2H2O
| ||
2 22.4L
0.02mol 0.224L
故答案为 0.224L.
点评:解题时注意以下几点:
1、混合溶液中离子的放电顺序.
2、发生电解反应的三个阶段.
只有明确知道这些问题才能正确解答本题.
1、混合溶液中离子的放电顺序.
2、发生电解反应的三个阶段.
只有明确知道这些问题才能正确解答本题.

练习册系列答案
相关题目

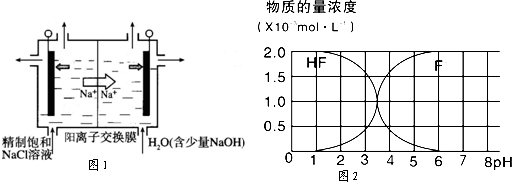
 Ⅰ、(1)在25℃条件下将pH=3的醋酸稀释100倍后溶液的pH为
Ⅰ、(1)在25℃条件下将pH=3的醋酸稀释100倍后溶液的pH为