题目内容
 Ⅰ、(1)在25℃条件下将pH=3的醋酸稀释100倍后溶液的pH为
Ⅰ、(1)在25℃条件下将pH=3的醋酸稀释100倍后溶液的pH为A.5 B.1 C.1~3之间D.3~5之间
(2)常温下,pH=3的盐酸和pH=11的氨水等体积混合后,混合溶液中c(Cl-)
(3)常温下,已知某CH3COONa溶液中的c(Na+)=c(CH3COO一),则该溶液的pH
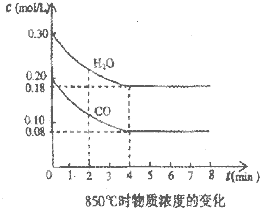
Ⅱ、在一体积为10L的密闭容器中,通入一定量的CO和H2O,在850℃发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g)△H<0.CO和H2O浓度变化如图:
(1)0一4min的平均反应速率v(CO)=
(2)850℃时,平衡常数K=
(3)下列措施中能使n(H2)/n(CO)增大的是
A.降低温度 B.充入He(g),使体系压强增大
C.将CO2 (g)从体系中分离 D.再充入0.2mol CO和0.3mol H2.
分析:I.(1)醋酸是弱电解质,加水稀释促进醋酸电离;
(2)pH=3的盐酸中c(H+)=10-3mol/L,pH=11的氨水中c(OH-)=10-3mol/L,两种溶液H+与OH-离子浓度相等,但由于氨水为弱电解质,不能完全电离,则氨水浓度大于盐酸浓度,二者等体积混合溶液呈碱性,根据电荷守恒判断;
(3)任何电解质溶液中都存在电荷守恒,根据电荷守恒判断;
II.(1)v=
进行计算;
(2)平衡时,c(H2O)=0.18mol/L,c(CO)=0.08mol/L,c(H2)=c(CO2)=(0.30-0.18)mol/L=0.12mol/L,
K=
,降低温度平衡向放热反应方向移动;
(3)要使n(H2)/n(CO)增大,则平衡向正反应方向移动,可以通过改变物质浓度、降低温度等方法来实现.
(2)pH=3的盐酸中c(H+)=10-3mol/L,pH=11的氨水中c(OH-)=10-3mol/L,两种溶液H+与OH-离子浓度相等,但由于氨水为弱电解质,不能完全电离,则氨水浓度大于盐酸浓度,二者等体积混合溶液呈碱性,根据电荷守恒判断;
(3)任何电解质溶液中都存在电荷守恒,根据电荷守恒判断;
II.(1)v=
| △c |
| △t |
(2)平衡时,c(H2O)=0.18mol/L,c(CO)=0.08mol/L,c(H2)=c(CO2)=(0.30-0.18)mol/L=0.12mol/L,
K=
| c(H2).c(CO2) |
| c(CO).c(H2O) |
(3)要使n(H2)/n(CO)增大,则平衡向正反应方向移动,可以通过改变物质浓度、降低温度等方法来实现.
解答:解:(1)醋酸是弱电解质,在溶液中部分电离,加水稀释时促进醋酸电离,所以将pH=3的醋酸稀释100倍后溶液中氢离子浓度大于原来的
,所以pH大于3而小于5,
故选D;
(2)pH=3的盐酸中c(H+)=10-3mol/L,pH=11的氨水中c(OH-)=10-3mol/L,两种溶液H+与OH-离子浓度相等,但由于氨水为弱电解质,不能完全电离,则氨水浓度大于盐酸浓度,反应后氨水过量,溶液呈碱性,溶液中c(H+)<c(OH-),溶液呈电中性,则c(H+)+c(NH4+)=c(OH-)+c(Cl-),所以c(NH4+)>c(Cl-),
故答案为:<;
(3)溶液中存在电荷守恒,根据电荷守恒得c(Na+)+c(H+)=c(OH-)+c(CH3COO-),溶液中c(Na+)=c(CH3COO-),所以c(H+)=c(OH-),故答案为:=;
II.(1)v=
=
=0.03 mol/(L.min),
故答案为:0.03;
(2)平衡时,c(H2O)=0.18mol/L,c(CO)=0.08mol/L,c(H2)=c(CO2)=(0.30-0.18)mol/L=0.12mol/L,
K=
=
=1,该反应的正反应是放热反应,降低温度平衡向正反应方向移动,则平衡常数增大,故答案为:1;增大;
(3)A.该反应是放热反应,降低温度平衡向正反应方向移动,则n(H2)/n(CO)增大,故A正确;
B.充入He(g),使体系压强增大,但反应物的物质的量浓度不变,则平衡不移动,故B错误;
C.将CO2 (g)从体系中分离,平衡向正反应方向移动,则n(H2)/n(CO)增大,故C正确;
D.再充入0.2mol CO和0.3mol H2,一氧化碳浓度=0.08mol/L+0.02mol/L=0.10mol/L,氢气浓度=0.12mol/L+0.03mol/L=0.15mol/L,浓度商=
=1=K,平衡不移动,故D错误;
故选AC.
| 1 |
| 100 |
故选D;
(2)pH=3的盐酸中c(H+)=10-3mol/L,pH=11的氨水中c(OH-)=10-3mol/L,两种溶液H+与OH-离子浓度相等,但由于氨水为弱电解质,不能完全电离,则氨水浓度大于盐酸浓度,反应后氨水过量,溶液呈碱性,溶液中c(H+)<c(OH-),溶液呈电中性,则c(H+)+c(NH4+)=c(OH-)+c(Cl-),所以c(NH4+)>c(Cl-),
故答案为:<;
(3)溶液中存在电荷守恒,根据电荷守恒得c(Na+)+c(H+)=c(OH-)+c(CH3COO-),溶液中c(Na+)=c(CH3COO-),所以c(H+)=c(OH-),故答案为:=;
II.(1)v=
| △c |
| △t |
| (0.20-0.08)mol/L |
| 4min |
故答案为:0.03;
(2)平衡时,c(H2O)=0.18mol/L,c(CO)=0.08mol/L,c(H2)=c(CO2)=(0.30-0.18)mol/L=0.12mol/L,
K=
| c(H2).c(CO2) |
| c(CO).c(H2O) |
| 0.12×0.12 |
| 0.18×0.08 |
(3)A.该反应是放热反应,降低温度平衡向正反应方向移动,则n(H2)/n(CO)增大,故A正确;
B.充入He(g),使体系压强增大,但反应物的物质的量浓度不变,则平衡不移动,故B错误;
C.将CO2 (g)从体系中分离,平衡向正反应方向移动,则n(H2)/n(CO)增大,故C正确;
D.再充入0.2mol CO和0.3mol H2,一氧化碳浓度=0.08mol/L+0.02mol/L=0.10mol/L,氢气浓度=0.12mol/L+0.03mol/L=0.15mol/L,浓度商=
| 0.15×0.12 |
| 0.10×0.18 |
故选AC.
点评:本题考查了弱电解质的电离及化学平衡,明确弱电解质电离特点及影响化学平衡的因素是解本题关键,结合电荷守恒来分析离子浓度大小,根据化学平衡常数K来进行计算,易错题是II(3)D,要根据浓度商与平衡常数大小判断移动方向,难度较大.

练习册系列答案
 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案
相关题目
 本题由两部分组成
本题由两部分组成 已知水在25℃和95℃时,其电离平衡曲线如图所示:
已知水在25℃和95℃时,其电离平衡曲线如图所示: