题目内容
(1)含有弱酸HA和其钠盐NaA的混合溶液,在化学上用作缓冲溶液.向其中加入少量酸或碱时,溶液的酸碱性变化不大.现将0.04mol?L-1HA溶液和0.02mol?L-1NaOH溶液等体积混合,得到缓冲溶液.
①若HA为HCN,该溶液显碱性,则溶液中c(CN-) c(Na+)(填“<”、“=”或“>”),你得出该结论的依据是 .
②若HA为CH3COOH,该溶液显酸性.溶液中所有的离子按浓度由大到小排列的顺序是 .
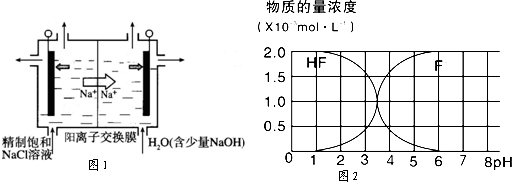
(2)二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂,目前已开发出用电解法制取ClO2的新工艺.
①如图示意用石墨做电极,在一定条件下电解饱和食盐水制取ClO2.写出阳极产生ClO2的电极反应式:
.
②电解一段时间,当阴极产生的气体体积为336mL(标准状况)时,停止电解.通过阳离子交换膜的阳离子的物质的量为 mol;用平衡移动原理解释阴极区pH增大的原因 .
(3)25℃时,2.0×10-3mol?L-1HF溶液中,调节溶液pH(忽略溶液体积变化)得到的(HF)、c(F-)与溶液pH的变化关系如图2.若将4.0×10-4mol?L-1CaCl2溶液与4.0×10-3mol?L-1HF溶液等体积混合,调节混合液pH=4(忽略调节时混合液体积的变化),通过列式计算说明是否有CaF2沉淀析出.[已知Ksp(CaF2):1.5×10-10] .

①若HA为HCN,该溶液显碱性,则溶液中c(CN-)
②若HA为CH3COOH,该溶液显酸性.溶液中所有的离子按浓度由大到小排列的顺序是
(2)二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂,目前已开发出用电解法制取ClO2的新工艺.
①如图示意用石墨做电极,在一定条件下电解饱和食盐水制取ClO2.写出阳极产生ClO2的电极反应式:
②电解一段时间,当阴极产生的气体体积为336mL(标准状况)时,停止电解.通过阳离子交换膜的阳离子的物质的量为
(3)25℃时,2.0×10-3mol?L-1HF溶液中,调节溶液pH(忽略溶液体积变化)得到的(HF)、c(F-)与溶液pH的变化关系如图2.若将4.0×10-4mol?L-1CaCl2溶液与4.0×10-3mol?L-1HF溶液等体积混合,调节混合液pH=4(忽略调节时混合液体积的变化),通过列式计算说明是否有CaF2沉淀析出.[已知Ksp(CaF2):1.5×10-10]
分析:(1)①从溶液电中性的角度比较离子浓度大小;
②若HA为CH3COOH,该溶液显酸性,说明c(H+)>c(OH-),结合溶液电中性原则分析;
(2)①由题意可知,氯离子放电生成ClO2,由元素守恒可知,有水参加反应,同时生成氢离子;
②在阴极发生2H++2e-=H2↑,通过阳离子交换膜的阳离子为+1价离子,根据n=
计算氢气的物质的量,根据电子转移守恒计算阳离子的物质的量,电解中H+浓度减小,使得H2O?OH-+H+的平衡向右移动;
(3)查图当PH=4时,溶液中C(F-)=1.6×10-3mol?L-1,则Qc=C(Ca2+)C2(F-)=5.12×10-10>Ksp(CaF2),所以有沉淀生成.
②若HA为CH3COOH,该溶液显酸性,说明c(H+)>c(OH-),结合溶液电中性原则分析;
(2)①由题意可知,氯离子放电生成ClO2,由元素守恒可知,有水参加反应,同时生成氢离子;
②在阴极发生2H++2e-=H2↑,通过阳离子交换膜的阳离子为+1价离子,根据n=
| V |
| Vm |
(3)查图当PH=4时,溶液中C(F-)=1.6×10-3mol?L-1,则Qc=C(Ca2+)C2(F-)=5.12×10-10>Ksp(CaF2),所以有沉淀生成.
解答:解:(1)①该溶液显碱性,则c(H+)<c(OH-),根据溶液电中性原则可知c(Na+)+c(H+)=C(CN-)+c(OH-),则c(Na+)>c(CN-),
故答案为:<;因为c(Na+)+c(H+)=C(CN-)+c(OH-),溶液显碱性,则c(H+)<c(OH-),所以c(Na+)>c(CN-);
②若HA为CH3COOH,该溶液显酸性,说明c(H+)>c(OH-),根据溶液电中性原则可知c(CH3COO-)>c(Na+),
故答案为:c(CH3COO-)>c(Na+)>c(H+)>c(OH-);
(2))①由题意可知,氯离子放电生成ClO2,由元素守恒可知,有水参加反应,同时生成氢离子,电极反应式为:Cl--5e-+2H2O=ClO2↑+4H+,
故答案为:Cl--5e-+2H2O=ClO2↑+4H+;
②在阴极发生2H++2e-=H2↑,氢气的物质的量为
=
0.015mol,通过阳离子交换膜的阳离子为+1价离子,故交换膜的阳离子的物质的量为0.015mol×2=0.03mol,电解中阴极H+浓度减小,使得H2O?OH-+H+的平衡向右移动,溶液的pH增大,
故答案为:0.03;在阴极发生2H++2e-=H2↑,H+浓度减小,使得H2O?OH-+H+的平衡向右移动,OH-浓度增大,pH增大;
(3)根据图知,当pH=4时,溶液中c(F-)=1.6×10-3mol/L,Qc=c(Ca2+).c2(F-)=2.0×10-3×(1.6×10-3)2=5.12×10-10>Ksp(CaF2),所以有沉淀生成,
故答案:当pH=4时,Qc=c(Ca2+).c2(F-)=2.0×10-3×(1.6×10-3)2=5.12×10-10>Ksp(CaF2),所以有沉淀生成.
故答案为:<;因为c(Na+)+c(H+)=C(CN-)+c(OH-),溶液显碱性,则c(H+)<c(OH-),所以c(Na+)>c(CN-);
②若HA为CH3COOH,该溶液显酸性,说明c(H+)>c(OH-),根据溶液电中性原则可知c(CH3COO-)>c(Na+),
故答案为:c(CH3COO-)>c(Na+)>c(H+)>c(OH-);
(2))①由题意可知,氯离子放电生成ClO2,由元素守恒可知,有水参加反应,同时生成氢离子,电极反应式为:Cl--5e-+2H2O=ClO2↑+4H+,
故答案为:Cl--5e-+2H2O=ClO2↑+4H+;
②在阴极发生2H++2e-=H2↑,氢气的物质的量为
| V |
| Vm |
| 0.336L |
| 22.4L/mol |
故答案为:0.03;在阴极发生2H++2e-=H2↑,H+浓度减小,使得H2O?OH-+H+的平衡向右移动,OH-浓度增大,pH增大;
(3)根据图知,当pH=4时,溶液中c(F-)=1.6×10-3mol/L,Qc=c(Ca2+).c2(F-)=2.0×10-3×(1.6×10-3)2=5.12×10-10>Ksp(CaF2),所以有沉淀生成,
故答案:当pH=4时,Qc=c(Ca2+).c2(F-)=2.0×10-3×(1.6×10-3)2=5.12×10-10>Ksp(CaF2),所以有沉淀生成.
点评:本题考查了电解原理应用,弱电解质的电离平衡分析,盐类水解的应用判断,电解质溶液中离子浓度大小比较,沉淀溶解平衡的计算应用,掌握基础是关键,题目难度中等.

练习册系列答案
相关题目