��Ŀ����
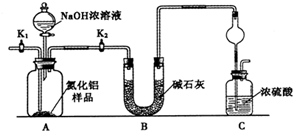
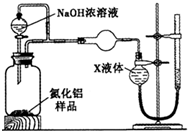
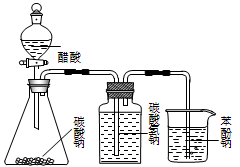
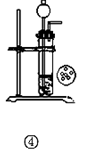
��12�֣���ʽ̼��þ[һ����xMgCO3?yMg(OH)2?zH2O��ʾ]�ܶ�С������������ˮ������ˮ���������ļ��Է�Ӧ���������Ҵ��������²���ֽ⣬������Ʒ���������ϡ�������������ͼ��
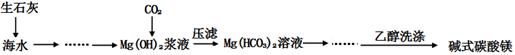
��1���ش��������⣺
����ʯ������ʯ��ʯ�뽹̿����������ɣ���̿�������ǣ� ��
��������þ��Һ��CO2��Ӧ�Ļ�ѧ����ʽΪ��
��
�ۼ�ʽ̼��þ���Ҵ�ϴ�ӵ�Ŀ���ǣ� ��
��2����֪����ʽ̼��þ�ֽⷴӦ����ʽΪ��
xMgCO3?yMg(OH)2?zH2O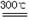 ��x+y��MgO+xCO2��+��y+z��H2O
��x+y��MgO+xCO2��+��y+z��H2O
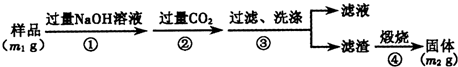
ijͬѧ��46.6g��ʽ̼��þ��Ʒ����Ӳ�ʲ������г�����������أ�������������Ϊ20.0g����������������ͨ��������Ũ���ᣬ��ͨ�������ļ�ʯ�ң���ʯ����������17.6g������ʵ��ⶨ�����ݣ�ȷ����ʽ̼��þ[xMgCO3��yMg(OH)2?zH2O]�Ļ�ѧʽ��Ҫ��д��������̣���
��1���ش��������⣺
����ʯ������ʯ��ʯ�뽹̿����������ɣ���̿�������ǣ� ��
��������þ��Һ��CO2��Ӧ�Ļ�ѧ����ʽΪ��
��
�ۼ�ʽ̼��þ���Ҵ�ϴ�ӵ�Ŀ���ǣ� ��
��2����֪����ʽ̼��þ�ֽⷴӦ����ʽΪ��
xMgCO3?yMg(OH)2?zH2O
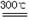 ��x+y��MgO+xCO2��+��y+z��H2O
��x+y��MgO+xCO2��+��y+z��H2Oijͬѧ��46.6g��ʽ̼��þ��Ʒ����Ӳ�ʲ������г�����������أ�������������Ϊ20.0g����������������ͨ��������Ũ���ᣬ��ͨ�������ļ�ʯ�ң���ʯ����������17.6g������ʵ��ⶨ�����ݣ�ȷ����ʽ̼��þ[xMgCO3��yMg(OH)2?zH2O]�Ļ�ѧʽ��Ҫ��д��������̣���
��1������ȼ�ϡ��ṩ���� ��2�֣�
�� Mg(OH)2+2CO2 = Mg(HCO3)2 ��2�֣�
�۳�ȥ�������ʡ����ٹ������� ��2�֣�
��2��������ã�
n(Mg2+)=20.0g/40g��mol-1=0.5mol ��1�֣�
n(CO2)=17.6g/44g��mol-1= 0.4mol ��1�֣�
��Ԫ���غ�ã�
m(MgCO3)=0.4mol��84g��mol-1=33.6g��1�֣�
m��Mg(OH)2��=(0.5mol-0.4mol)=5.8g��1�֣�
n(H2O)=44.6g-33.6g-5.8g/18g��mol-1=0.4mol��1�֣�
x:y:z=4:1:4
���ʽ̼��þ�Ļ�ѧʽΪ��4MgCO3��Mg(OH)2��4H2O��1�֣����������̺���Ҳ���֣�
�� Mg(OH)2+2CO2 = Mg(HCO3)2 ��2�֣�
�۳�ȥ�������ʡ����ٹ������� ��2�֣�
��2��������ã�
n(Mg2+)=20.0g/40g��mol-1=0.5mol ��1�֣�
n(CO2)=17.6g/44g��mol-1= 0.4mol ��1�֣�
��Ԫ���غ�ã�
m(MgCO3)=0.4mol��84g��mol-1=33.6g��1�֣�
m��Mg(OH)2��=(0.5mol-0.4mol)=5.8g��1�֣�
n(H2O)=44.6g-33.6g-5.8g/18g��mol-1=0.4mol��1�֣�
x:y:z=4:1:4
���ʽ̼��þ�Ļ�ѧʽΪ��4MgCO3��Mg(OH)2��4H2O��1�֣����������̺���Ҳ���֣�
�����������1����CaCO3���·ֽ�����CaO��CO2�����Խ�̿�������ǣ���ȼ�ϡ��ṩ������
�ڸ�������ͼ��CO2��Mg(OH)2��Ӧ��IJ��ᆳѹ�˵õ�Mg(HCO3)2������CO2��Mg(OH)2��Ӧ�Ļ�ѧ����ʽΪ��Mg(OH)2+2CO2 = Mg(HCO3)2
����Ϊ��ʽ̼��þ��ˮ���������ļ��Է�Ӧ���������Ҵ����������Ҵ�ϴ�ӿ��Գ�ȥ�������ʡ����ٹ������ġ�
��2����������ΪCaO����ʯ������CO2������������ΪCO2���������ɵã�
n(Mg2+)=20.0g/40g��mol-1=0.5mol ��1�֣�
n(CO2)=17.6g/44g��mol-1= 0.4mol ��1�֣�
��Ԫ���غ�ã�
m(MgCO3)=0.4mol��84g��mol-1=33.6g��1�֣�
m��Mg(OH)2��=(0.5mol-0.4mol)=5.8g��1�֣�
n(H2O)=44.6g-33.6g-5.8g/18g��mol-1=0.4mol��1�֣�
x:y:z=4:1:4
���ʽ̼��þ�Ļ�ѧʽΪ��4MgCO3��Mg(OH)2��4H2O��1�֣�

��ϰ��ϵ�д�
�����Ŀ