题目内容
一包粗盐中可能含有Na2SO4,Na2CO3杂质中的一种或两种,某同学为了探究清楚粗盐杂质成分进行了以下实验,请帮他完成实验.
(1)提出假设:
假设1:粗盐中只含有Na2CO3;
假设2:______
假设3:粗盐中既含有Na2CO3又含有Na2SO4
(2)请设计实验完成对粗盐杂质成分的探究,写成实验步骤以及预期现象和结论.
限选实验试剂:稀盐酸,氯化钡溶液,澄清石灰水.
(3)写出整个实验中可能涉及到的化学反应的离子方程式①______;②______;③______.
(1)提出假设:
假设1:粗盐中只含有Na2CO3;
假设2:______
假设3:粗盐中既含有Na2CO3又含有Na2SO4
(2)请设计实验完成对粗盐杂质成分的探究,写成实验步骤以及预期现象和结论.
限选实验试剂:稀盐酸,氯化钡溶液,澄清石灰水.
| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量粗盐于试管中,往试管中滴加过量稀盐酸,并用带导管的胶塞迅速塞住试管,导管的另一端通入澄清石灰水,观察现象, | (1)若能观察到试管中有气泡产生,产生的气体能使澄清石灰水变浑浊,则说明假设1或假设3成立;(2)若无明显现象则说明______成立. |
| 步骤2:继续往试管中滴加______,观察现象. | (1)若能观察到______结合步骤1中的(1)则说明______成立; (2)若无明显现象,结合步骤1中(1)则说明______成立. |
(1)根据粗盐中可能含有Na2SO4,Na2CO3杂质中的一种或两种,含有杂质的可能情况为:①只含有Na2CO3、②只含Na2SO4、③既含有Na2CO3又含有Na2SO4,结合假设1、3可知,假设2为粗盐中只含有Na2SO4,
故答案为:粗盐中只含有Na2SO4;
(2)步骤1:硫酸钠与盐酸不反应,滴加盐酸无明显现象,说明不含碳酸钠,则假设2成立;
步骤2:检验是否含有硫酸钠,可以检验溶液中是否含有硫酸根加快,向步骤1的溶液中继续滴加氯化钡溶液,有白色沉淀生成,说明溶液中含有硫酸根,结合步骤1中有气泡产生,产生的气体能使澄清石灰水变浑浊,说明含有碳酸钠,故粗盐含有碳酸钠、硫酸钠,假设3成立;
若无明显现象,结合步骤1中有气泡产生,产生的气体能使澄清石灰水变浑浊,说明该粗盐含有碳酸钠,则假设1成立.
故答案为:
(3)实验中可能的反应有:
①碳酸钠与盐酸反应生成二氧化碳与水,离子方程式为:CO32-+2H+=CO2↑+H2O;
②二氧化碳与氢氧化钙反应生成碳酸钙与水为:CO2+Ca2++2OH-=CaCO3↓+H2O;
③硫酸钠与氯化钡反应生成硫酸钡与氯化钠为:Ba2++SO42-=BaSO4↓,
故答案为:CO32-+2H+=CO2↑+H2O;CO2+Ca2++2OH-=CaCO3↓+H2O;Ba2++SO42-=BaSO4↓.
故答案为:粗盐中只含有Na2SO4;
(2)步骤1:硫酸钠与盐酸不反应,滴加盐酸无明显现象,说明不含碳酸钠,则假设2成立;
步骤2:检验是否含有硫酸钠,可以检验溶液中是否含有硫酸根加快,向步骤1的溶液中继续滴加氯化钡溶液,有白色沉淀生成,说明溶液中含有硫酸根,结合步骤1中有气泡产生,产生的气体能使澄清石灰水变浑浊,说明含有碳酸钠,故粗盐含有碳酸钠、硫酸钠,假设3成立;
若无明显现象,结合步骤1中有气泡产生,产生的气体能使澄清石灰水变浑浊,说明该粗盐含有碳酸钠,则假设1成立.
故答案为:
| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量粗盐于试管中,往试管中滴加过量稀盐酸,并用带导管的胶塞迅速塞住试管,导管的另一端通入澄清石灰水,观察现象, | (1)若能观察到试管中有气泡产生,产生的气体能使澄清石灰水变浑浊,则说明假设1或假设3成立; (2)若无明显现象则说明 假设2 成立. |
| 步骤2:继续往试管中滴加 氯化钡溶液,观察现象. | (1)若能观察到 不溶于稀盐酸的白色沉淀生成,结合步骤1中的(1)则说明 假设3 成立; (2)若无明显现象,结合步骤1中(1)则说明 假设1 成立. |
①碳酸钠与盐酸反应生成二氧化碳与水,离子方程式为:CO32-+2H+=CO2↑+H2O;
②二氧化碳与氢氧化钙反应生成碳酸钙与水为:CO2+Ca2++2OH-=CaCO3↓+H2O;
③硫酸钠与氯化钡反应生成硫酸钡与氯化钠为:Ba2++SO42-=BaSO4↓,
故答案为:CO32-+2H+=CO2↑+H2O;CO2+Ca2++2OH-=CaCO3↓+H2O;Ba2++SO42-=BaSO4↓.

练习册系列答案
相关题目
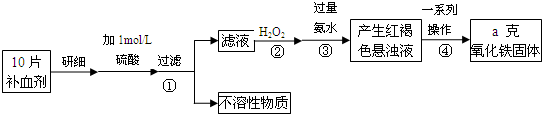
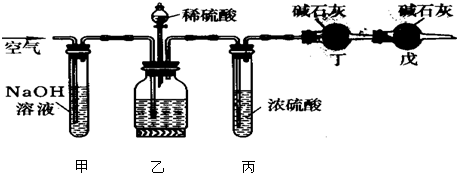

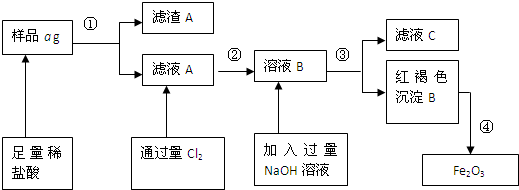
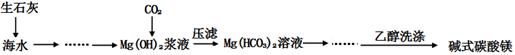
 (x+y)MgO+xCO2↑+(y+z)H2O
(x+y)MgO+xCO2↑+(y+z)H2O