题目内容
【题目】依据氧化还原反应Zn(s)+Cu2+(aq)===Zn2+(aq)+Cu(s)设计的原电池如下图所示。
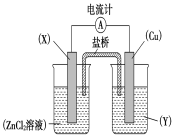
请回答下列问题:
(1)电极X的材料是____________;电解质溶液Y是__________________。
(2)铜电极为电池的________极,发生的电极反应为_______________________ X极上发生的电极反应为______________。
(3)外电路中的电子是从________极流向__________极(填名称)。
(4)盐桥中的Cl-向________极移动,如将盐桥撤掉,电流计的指针将________偏转。
【答案】Zn CuSO4溶液或CuCl2溶液 正极 Cu2++2e-=Cu Zn-2e-=Zn2+ 锌 铜 锌 不
【解析】
原电池中存在一个自发进行的氧化还原反应,Zn的化合价升高,作负极,即图中X为锌,铜作正极,其电极反应式为Cu2++2e-=Cu,X电极为负极,失电子,其电极反应式为Zn-2e-=Zn2+。
(1)由Zn(s)+Cu2+(aq)=Zn2+(aq)+Cu(s)反应可知,锌的化合价升高,被氧化,作负极,铜为正极,则电解质溶液为氯化铜或硫酸铜;
(2)铜为正极,是溶液中的铜离子得到电子,电极反应为:Cu2++2e-=Cu,锌为负极,失去电子生成锌离子,电极反应为Zn—2e-=Zn2+;
(3)原电池工作时,电子从负极经过导线流向正极,所以从Zn流向Cu;
(4)原电池工作时,阴离子向负极移动,即向Zn极移动,若将盐桥撤掉,则不能形成闭合回路,电流计的指针不能偏转。

 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案【题目】某地湖盐中含有Ca2+、Mg2+、Fe3+、SO42-等杂质离子,氨碱厂用该地湖盐制取烧碱。其中制得精制食盐水的过程如下:

(1)过程Ⅰ中将粗盐加水溶解需要适当加热,其目的是__________。
(2)过程Ⅱ的目的是除去SO42-,加入的X溶液是__________。
(3)下表是过程Ⅱ、Ⅲ中生成的部分沉淀及其在20℃时的溶解度[g/100gH2O]
CaSO4 | Mg2(OH)2CO3 | CaCO3 | BaSO4 | BaCO3 | Fe(OH)3 |
2.6×10-2 | 2.5×10-4 | 7.8×10-4 | 2.4×10-4 | 1.7×10-3 | 4.8×10-9 |
①过程Ⅲ中生成的主要沉淀除CaCO3和Fe(OH)3外还有__________。
②过程Ⅳ中调节pH时发生的主要反应的离子方程式为__________。
(4)上述精制食盐水中还含有微量的I-、IO3-、NH4+、Ca2+、Mg2+,除去这些离子及进行电解的流程如下:
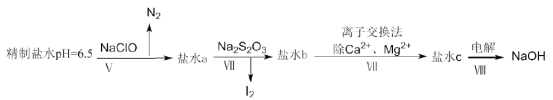
①过程V生成N2的离子方程式为__________。
②过程Ⅳ可以通过控制Na2S2O3的量,将IO3-还原成I2,且盐水b中含有SO42-,该过程中发生氧化还原反应,其中氧化剂和还原剂的物质的量之比为__________。
③在过程Ⅳ中所用的Na2S2O3俗称海波,是一种重要的化工原料。商品海波主要成分是Na2S2O3·5H2O。为了测定其含Na2S2O3·5H2O的纯度,称取8.00g样品,配成250mL溶液,取25.00mL于锥形瓶中,滴加淀粉溶液作指示剂,再用浓度为0.0500mol·L-1的碘水滴定(发生反应2S2O32-+I2=S4O62-+2I-),下表记录滴定结果:
滴定次数 | 滴定前读数(mL) | 滴定后读数(mL) |
第一次 | 0.30 | 29.12 |
第二次 | 0.36 | 30.56 |
第三次 | 1.10 | 29.88 |
计算样品的纯度为__________。