题目内容
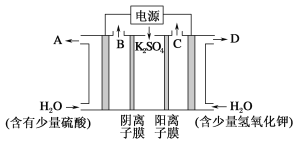
【题目】硫酸在下列用途或反应中所表现的性质(用字母填在横线上)。
A.难挥发性 B.强酸性 C.吸水性 D.脱水性 E.强氧化性
① 浓硫酸可用作气体干燥剂 __________;
② 往晶体硫酸铜中加浓硫酸,晶体变白___________;
③ 浓硫酸与铜反应__________;
④ 运用铁制槽车和铝制槽车运输浓硫酸_________;
⑤ 浓硫酸使润湿蓝色石蕊试纸先变红后又变黑___________ 。
【答案】(5分)① C ② C ③ BE ④ E ⑤ BD(每空1分)
【解析】
试题①浓硫酸具有吸水性,所以浓硫酸可用作气体干燥剂,答案选C。
② 同样由于浓硫酸具有吸水性,所以往晶体硫酸铜中加浓硫酸,晶体变白,答案选C。
③根据反应式Cu+2H2SO4(浓)![]() CuSO4+2H2O+SO2↑可知,在该反应中浓硫酸表现的是酸性和强氧化性,答案选BE。
CuSO4+2H2O+SO2↑可知,在该反应中浓硫酸表现的是酸性和强氧化性,答案选BE。
④常温下铝或铁在浓硫酸中发生钝化,所以可以运用铁制槽车和铝制槽车运输浓硫酸,表现的是浓硫酸的强氧化性,答案选E。
⑤浓硫酸具有酸性和脱水性,所以浓硫酸使润湿蓝色石蕊试纸先变红后又变黑,答案选BD。

 智慧小复习系列答案
智慧小复习系列答案【题目】下表是元素周期表的一部分,表中所列的字母分别代表某一元素。
B | C | D | |||||
A | E | F | |||||
(1)A的的最高价氧化物对应水化物的电子式为__________。
(2)R是由表中已标出的A~F 中某三种元素组成的化合物,是常见家用消毒剂的主要成分,其化学名称为_____________;Na2FeO4是工业常用的消毒剂,利用R 制备Na2FeO4的原理如下,请补齐缺少的物质,并配平反应方程式的系数:___ Fe(OH)3 + ___R(________) + ___ NaOH = ____ Na2FeO4 + ___ NaCl + ____H2O
(3)气态氢化物沸点:D _____ E;元素形成的简单离子的半径:A _____ D(填“>”,“<”或“=”)
(4)E 的某种氧化物通入F 单质的水溶液中,并不能增大F 单质水溶液的漂白性,请结合方程式说明______________________________________________________________。
(5)由表中未标出的某种金属元素的单质G ,可以发生如图所示的转化:
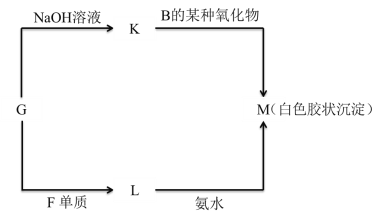
①写出 G 转化为 K 的化学方程式________________________________________。
②写出 L 转化为 M 的离子方程式________________________________________。