题目内容
【题目】某温度时,在2 L的密闭容器中,X、Y、Z三种物质的量随时间的变化曲线如图所示。
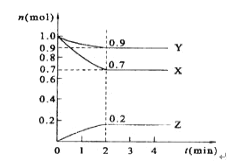
(1)X的转化率是_____;
(2)由图中所给数据进行分析,该反应的化学方程式为______;
(3)反应从开始至2分钟末,用Z的浓度变化表示的平均反应速率为v(Z)=_____;
(4)当反应进行到第____min,该反应达到平衡。若三种物质都是气体,平衡时Y所占体积的百分比为_____;
(5)该反应达平衡时的平衡常数表达式:_________。
【答案】30% 3X+Y![]() 2Z 0.05mol/(L·min) 2 50%
2Z 0.05mol/(L·min) 2 50% ![]()
【解析】
(1)根据转化率=![]() ×100%计算;
×100%计算;
(2)根据参加反应的物质的物质的量之比等于化学计量数之比书写化学方程式;
(3)根据v=![]() 计算;
计算;
(4)根据化学平衡特征判断达到平衡的时间;根据平衡时体积百分比等于物质的量的百分比计算;
(5)根据反应式写出平衡常数表达式。
(1)由图可知,起始时X的物质的量为1.0mol,反应到2min时X的物质的量为0.7mol,所以转化的X为0.3mol,则X的转化率是:![]() ×100% =30%,
×100% =30%,
故答案为:30%;
(2)由图象可以看出,反应中X、Y的物质的量减少,应为反应物,Z的物质的量增多,应为生成物,当反应进行到2min时,△n(X)=0.3mol,△n(Y)=0.1mol,△n(Z)=0.2mol,则△n(X):△n(Y):△n(Z)=3:1:2,参加反应的物质的物质的量之比等于化学计量数之比,则反应的方程式为:3X+Y![]() 2Z,
2Z,
故答案为:3X+Y![]() 2Z;
2Z;
(3)反应开始至2min末,Z的反应速率为:v=![]() =
=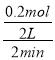 =0.05mol/(L·min),
=0.05mol/(L·min),
故答案为:0.05mol/(L·min);
(4)由图象可以看出,当反应进行到第2min,X、Y、Z的含量不再改变,该反应达到平衡。
平衡时X、Y、Z的物质的量分别为0.7mol、0.9mol和0.2mol,则Y所占体积的百分比为![]() ×100%=50%,
×100%=50%,
故答案为:2;50%;
(5)根据反应式3X(g)+Y(g)![]() 2Z(g),平衡常数表达式为:
2Z(g),平衡常数表达式为:![]() ,
,
故答案为:![]() 。
。

 口算题天天练系列答案
口算题天天练系列答案【题目】SO2为无色、有强烈刺激性气味的气体,是主要大气污染物之一,具有一定的还原性。
I. 探究 SO2 还原 Fe3+、I2。可使用的药品和装置如下图所示。

(1)实验室常用亚硫酸钠与 70%硫酸 加热制备二氧化硫,写出该反应的化学方程式_________________________________。
(2)B中可观察到的现象是__________________。
(3)C的作用是______________。
(4)设计实验检验A 中SO2与Fe3+反应所得还原产物____________________。
Ⅱ.某同学将SO2与漂粉精进行如下实验探究。
操 作 | 现 象 |
取适量漂粉精固体,加入 100 mL 水 | 大部分固体溶解,溶液略有颜色 |
过滤,用 pH 试纸测漂粉精溶液的 pH | pH 试纸先变蓝(约为12),后褪色 |
将 SO2 持续通入漂粉精溶液中 | ①溶液出现浑浊,并呈淡黄绿色 |
②一段时间后,产生较多白色沉淀,黄绿色褪去 | |
(1)由 pH 试纸颜色变化说明漂粉精溶液具有的性质是______________________________。
(2)①中溶液呈淡黄绿色的可能原因是_________________________________;用离子方程式解释②中溶液黄绿色褪去的主要原因___________________________。