��Ŀ����
����Ŀ�������ڹ�ҵ��������Ҫ����;��ij��ȤС����ʵ������ģ�ҵ���������Ʊ���ˮ�Ȼ�������ˮAlCl3����ʪ������������������������������װ���Ʊ���

��1��װ��B��ʢ��__________��Һ����������___________��F�е���________��Һ����������_____________����һ������װ���ʵ��Լ���Ҳ����F��G�����ã���װ����Լ�Ϊ________��
��2��װ��Aʵ�鿪ʼʱ���ȼ��װ�������ԣ��������IJ���������_____________������ţ���
A������ƿ�м���MnO2��ĩ B������ C������ƿ�м���Ũ����
��3���Ʊ���Ӧ��������Ũ���½���ֹͣ��Ϊ�ⶨ��Ӧ����Һ�������Ũ�ȣ�̽��С��ͬѧ����ܶ�ʵ�鷽�������з���֮һΪ�ò�����Һ��������Zn��Ӧ���������ɵ�H2�����װ����ͼ��ʾ���г���������ȥ������Ӧ��ϣ�ÿ���1���Ӷ�ȡ������������������С��ֱ�����䣮���������μ�С��ԭ����____________________���ų�������ʵ�������Ӱ�����أ���

��4����С��ͬѧ�����ϵ�֪��������ع����Ũ������Ҳ������������ͬʱ�д���ClO2���ɣ�ClO2�е�Ϊ10�棬�۵�Ϊ��59�棬Һ��Ϊ��ɫ��Cl2�е�Ϊ��34�棬Һ̬Ϊ����ɫ��������ʵ����֤Cl2�к���ClO2___________________��
���𰸡�����ʳ��ˮ ��ȥ�Ȼ������� Ũ���� ��ֹG�е�ˮ��������E�� ��ʯ�� ACB ����δ��ȴ������ �ռ�һ�Թ����壬���Ͻ����������ˮ������У��۲�Һ�壨�����壩��ɫ�仯
��������
����ʵ��װ��ͼ��֪����ʵ������Ũ������������̷�Ӧ�������������������Ȼ��⡢ˮ�����ʣ����ñ���ʳ��ˮ���Ȼ��⣬����Ũ����������������Ӧ�Ƶ��Ȼ�������Ӧ��β�����������������������գ�Ϊ��ֹ�Ȼ���������������Һ�е�ˮ������Ӧ���������ռ�װ�ú�β������װ��֮���һ����װ��F��
��1������������װ��ͼ��֪��װ��A��ʵ��������Ũ������������̷�Ӧ�Ʊ��������Ƶõ������к����Ȼ����ˮ�����ʣ�����Bװ����Ӧװ����ʳ��ˮ��Ϊ�˳�ȥ���е�HCl���壻��Ϊ�Ȼ�������ˮ�⣬��FӦ�÷�ֹ�����е�ˮ��������Eװ�ã�����Eװ����Ӧ��Ũ���ᣬ��G�����շ�Ӧʣ������������Կ��Լ����ʯ��������F��G�����ã��ʴ�Ϊ������ʳ��ˮ����ȥ�Ȼ������壻Ũ�����ֹG�е�ˮ��������E�У���ʯ�ң�
��2��װ��Aʵ������Ũ������������̷�Ӧ��ȡ������Ӧ�ȼӶ������̣��ٴӷ�Һ©���м���Ũ���ᣬ�ټ��ȣ����Բ���˳��ΪACB���ʴ�Ϊ��ACB��
��3����Ӧ��Ϻ�ÿ���1���Ӷ�ȡ������������������С��ԭ��������δ��ȴ�����£����¶���ȴ�����º�����������ٸı䣬�ʴ�Ϊ������δ��ȴ�����£�
��4������ClO2�е�Ϊ10�棬�۵�Ϊ-59�棬Һ��Ϊ��ɫ��Cl2�е�Ϊ-34�棬Һ̬Ϊ����ɫ��Ϊ��֤Cl2�к���ClO2���ռ�һ�Թ����壬���Ͻ����������ˮ������У��۲�Һ�壨�����壩��ɫ�仯�������ֺ�ɫ����˵��Cl2�к���ClO2���ʴ�Ϊ���ռ�һ�Թ����壬���Ͻ����������ˮ������У��۲�Һ�壨�����壩��ɫ�仯��

 ��ʱѵ���������������ϵ�д�
��ʱѵ���������������ϵ�д� �ƸԾ���Ȥζ����ϵ�д�
�ƸԾ���Ȥζ����ϵ�д� ����С����ҵ��ϵ�д�
����С����ҵ��ϵ�д�����Ŀ���±���Ԫ�����ڱ���һ���֣��������е���ĸ�ֱ����ijһԪ�ء�
B | C | D | |||||
A | E | F | |||||
��1��A�ĵ�����������Ӧˮ����ĵ���ʽΪ__________��
��2��R���ɱ����ѱ����A~F ��ij����Ԫ����ɵĻ�����dz�����������������Ҫ�ɷ֣��仯ѧ����Ϊ_____________��Na2FeO4�ǹ�ҵ���õ�������������R �Ʊ�Na2FeO4��ԭ�����£��벹��ȱ�ٵ����ʣ�����ƽ��Ӧ����ʽ��ϵ����___ Fe(OH)3 + ___R��________�� + ___ NaOH = ____ Na2FeO4 + ___ NaCl + ____H2O
��3����̬�⻯��е㣺D _____ E��Ԫ���γɵļ����ӵİ뾶��A _____ D���>������<����=����
��4��E ��ij��������ͨ��F ���ʵ�ˮ��Һ�У�����������F ����ˮ��Һ��Ư���ԣ����Ϸ���ʽ˵��______________________________________________________________��
��5���ɱ���δ�����ij�ֽ���Ԫ�صĵ���G �����Է�����ͼ��ʾ��ת����
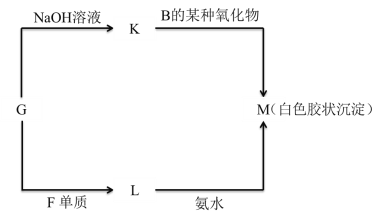
��д�� G ת��Ϊ K �Ļ�ѧ����ʽ________________________________________��
��д�� L ת��Ϊ M �����ӷ���ʽ________________________________________��