题目内容
【题目】下列指定反应的离子方程式正确的是( )
A.用石墨电极电解MgCl2溶液:2Cl-+2H2O![]() 2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑
B.向AlCl3溶液中加入过量氨水:Al3++4NH3·H2O=4NH4++AlO2-+2H2O
C.乙醛与新制Cu(OH)2悬浊液加热:CH3CHO+2Cu(OH)2+OH-![]() CH3COO-+Cu2O↓+3H2O
CH3COO-+Cu2O↓+3H2O
D.向Ba(OH)2溶液中加入过量NH4HSO4溶液:Ba2++2OH-+NH4++H++SO42-=BaSO4↓+NH3·H2O+H2O
【答案】C
【解析】
A.电解氯化镁溶液时,阴极水电离出的氢离子放电生成氢气,同时产生氢氧根,氢氧根与镁离子结合会生成氢氧化镁沉淀,正确的例子方程式为2Cl-+2H2O+Mg2+![]() Mg(OH)2↓+H2↑+Cl2↑,故A错误;
Mg(OH)2↓+H2↑+Cl2↑,故A错误;
B.氨水为弱碱不能和氢氧化铝反应,正确离子方程式为Al3++3NH3H2O=Al(OH)3↓+3NH4+,故B错误;
C.乙醛与新制的Cu(OH)2悬浊液加热产生砖红色沉淀,离子反应为CH3CHO+2Cu(OH)2+OH-![]() CH3COO-+Cu2O↓+3H2O,故C正确;
CH3COO-+Cu2O↓+3H2O,故C正确;
D.向Ba(OH)2溶液中加入过量的NH4HSO4溶液,此时铵根不能反应,离子反应为Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O,故D错误;

 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案【题目】在T℃条件下,向1L固定体积的密闭容器M中加入2molX和1molY,发生如下反应:2X(g)+Y(g)![]() a Z(g)+W(g) ΔH=-890kJ·mol-1(a为正整数)。
a Z(g)+W(g) ΔH=-890kJ·mol-1(a为正整数)。
当反应达到平衡后,反应放出的热量为Q1kJ,物质X的转化率为α;若平衡后再升高温度,混合气体的平均相对分子质量减小,则
(1)化学计量数a的值为_____。
(2)温度维持T ℃不变,若起始时向容器M中加入4molX和6molY,若达到平衡时容器内的压强减小了10%,则反应中放出的热量为___kJ。
(3)温度维持T ℃不变,若在一个和原容器体积相等的恒压容器N中,加入2molX和1 molY发生如上反应并达平衡,则容器中X的质量分数M___N(选填>、<、=符号)。
(4)已知:该反应的平衡常数随温度的变化如表:
温度/℃ | 200 | 250 | 300 | 350 |
平衡常数K | 9.94 | 5.2 | 1 | 0.5 |
若在某温度下,2molX和1molY在容器M中反应达平衡, X的平衡转化率为50%,则该温度为_____℃。平衡时 X的体积分数为____。
【题目】某研究性学习小组利用H2C2O4溶液和酸性KMnO4溶液的反应探究“外界条件的改变对化学反应速率的影响”,进行了如下实验:
实验序号 | 实验 温度/K | 有关物质 | 溶液颜色褪至无色所需时间/s | ||||
酸性KMnO4溶液 | H2C2O4溶液 | H2O | |||||
V/mL | c/ mol·L-1 | V mL | c/ mol·L-1 | V/mL | |||
A | 293 | 2 | 0.02 | 4 | 0.1 | 0 | t1 |
B | T1 | 2 | 0.02 | 3 | 0.1 | V1 | 8 |
C | 313 | 2 | 0.02 | V2 | 0.1 | 1 | t2 |
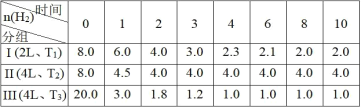
(1)其中V1=_____、T1=_____;通过实验_____(填实验序号)可探究出温度变化对化学反应速率的影响,其中V2=______。
(2)若t1<8,则由此实验可以得出的结论是_____;忽略溶液体积的变化,利用实验B中数据计算,0~8s内,用KMnO4的浓度变化表示的反应速率v(KMnO4)=_______。
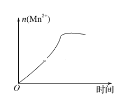
(3)该小组的一位同学通过查阅资料发现,上述实验过程中n(Mn2+)随时间的变化情况如图所示,并认为造成这种变化的原因是反应体系中的某种粒子对KMnO4与草酸之间的反应有某种特殊作用,则该作用是_______。