题目内容
【题目】某小组在探究Fe2+性质的实验中观察到异常现象。
实验Ⅰ | 现象 |
| 溶液变红,片刻红色褪去,有气体生成(经检验为O2)。 |
资料:ⅰ.Fe3++3SCN-=Fe(SCN)3(红色),Fe(SCN)3中S元素的化合价为2价
ⅱ.BaSO4是不溶于盐酸的白色沉淀
(1)实验Ⅰ体现了Fe2+的__性,补全H2O2与FeCl2酸性溶液反应的离子方程式:__Fe2+ +__H2O2+__H+ =__Fe3++__H2O
(2)探究“红色褪去”的原因,进行实验Ⅱ:将褪色后的溶液分三份分别进行实验。

实验Ⅱ得出的结论是:红色褪去的原因是__。
(3)为进一步探究“红色褪去”的原因,进行了实验Ⅲ。
实验Ⅲ | 现象 |
| 溶液变红,一段时间后不褪色。 |
取上述反应后的溶液,滴加盐酸和BaCl2溶液 | 无白色沉淀产生。 |
分析上述三个实验,下列叙述正确的是__(填字母)。
A.实验Ⅲ中发生了氧化还原反应:4Fe2++O2+4H+=4Fe3++2H2O
B.通过实验Ⅲ推出实验Ⅰ中氧化FeCl2的只有O2
C.O2在该实验条件下不能使红色溶液褪色
D.实验Ⅰ中红色褪去与H2O2的氧化性有关
(4)上述实验探究过程用到的实验方法有__(写出一条)。
【答案】还原 2 1 2 2 2 SCN-[或Fe(SCN)3]被氧化为SO42- ACD 对比、控制变量等
【解析】
(1)实验Ⅰ向氯化亚铁和硫氰化钾的混合溶液中加入双氧水,溶液变为血红色,说明二价铁被氧化为三价铁,三价铁离子与硫氰根离子结合变红色溶液,体现了Fe2+的还原性;
(2)将褪色后的溶液分三份分别进行实验对褪色溶液研究,实验Ⅱ说明溶液中铁离子没有变化,有硫酸根离子生成;
(3)为进一步探究“红色褪去”的原因,进行了实验Ⅲ,另取同浓度的 FeCl2溶液滴加2滴试剂KSCN溶液,再通入O2,溶液变红,说明O2能氧化亚铁离子生成三价铁离子,取上述反应后的溶液,滴加盐酸和BaCl2溶液,无白色沉淀产生,说明氧气不能氧化SCN,则该硫酸根离子由H2O2将SCN氧化成SO42;
(4)实验Ⅰ和实验Ⅲ同种(同浓度,同体积)溶液中加入不同的物质,得到不同的反应现象,运用了对比、控制变量的试验方法。
(1)实验Ⅰ向氯化亚铁和硫氰化钾的混合溶液中加入双氧水,溶液变为血红色,说明二价铁被氧化为三价铁,三价铁离子与硫氰根离子结合变红色溶液,体现了Fe2+的还原性, H2O2与FeCl2酸性溶液反应的离子方程式:2Fe2+ +H2O2 +2H+ =2Fe3++2H2O;
故答案为:还原;2;1;2;2;2;
(2)通过实验Ⅱ三分溶液的变化现象,说明溶液中铁离子没有变化,有硫酸根离子生成,说明实验Ⅰ中加入的双氧水将SCN-[或Fe(SCN)3]被氧化为SO42-,
故答案为:SCN-[或Fe(SCN)3]被氧化为SO42-;
(3)另取同浓度的 FeCl2溶液滴加2滴试剂KSCN溶液,再通入O2,溶液变红,说明O2能氧化亚铁离子生成三价铁离子,取上述反应后的溶液,滴加盐酸和BaCl2溶液,无白色沉淀产生,说明氧气不能氧化SCN,则该硫酸根离子由H2O2将SCN氧化成SO42;
A. FeCl2溶液滴加2滴试剂KSCN溶液,再通入O2,溶液变红,说明O2能氧化亚铁离子生成三价铁离子实验Ⅲ中发生了氧化还原反应:4Fe2++O2+4H+=4Fe3++2H2O,故A正确;
B. 通过实验Ⅲ推出实验Ⅰ中被氧化FeCl2的有双氧水,故B错误;
C. 滴加盐酸和BaCl2溶液,无白色沉淀产生,说明氧气不能氧化SCN,在该实验条件下不能使红色溶液褪色,故C正确;
D. 实验Ⅰ中红色褪去是由于H2O2将SCN氧化成SO42,因此与H2O2的氧化性有关,故D正确;
故答案为ACD;
(4)实验Ⅰ和实验Ⅲ同种(同浓度,同体积)溶液中加入不同的物质,得到不同的反应现象,运用了对比、控制变量的试验方法,
故答案为:对比、控制变量等。

 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案【题目】我国化学家侯德榜发明的“联合制碱法”为世界制碱工业做出了巨大贡献。如图为联合制碱法的主要过程(部分物质已略去)。
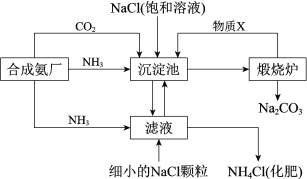
资料:ⅰ.沉淀池中的反应为NaCl+CO2+NH3+H2O=NaHCO3↓+NH4Cl
ⅱ.溶解度
物质 | NaCl | NH4HCO3 | NaHCO3 | NH4Cl |
20°C溶解度/g | 36.0 | 21.7 | 9.6 | 37.2 |
(1)煅烧炉中反应的化学方程式是___,物质X是___(填化学式)。
(2)下列说法正确的是__(填字母)。
A.沉淀池中有NaHCO3析出,因为一定条件下NaHCO3的溶解度最小
B.滤液中主要含有NaCl、Na2CO3和NH4Cl
C.设计循环的目的是提高原料的利用率
(3)工业可用纯碱代替烧碱生产某些化工产品,如用饱和纯碱溶液与Cl2反应可制得一种在生产生活中常用于漂白、消毒的物质,同时有NaHCO3生成,该反应的化学方程式是___。
(4)某纯碱样品中含杂质NaCl,取质量为ag的样品,加入足量的稀盐酸,充分反应后,加热、蒸干、灼烧,得到bg固体物质,则此样品中Na2CO3的质量分数为__。
【题目】某研究性学习小组利用H2C2O4溶液和酸性KMnO4溶液的反应探究“外界条件的改变对化学反应速率的影响”,进行了如下实验:
实验序号 | 实验 温度/K | 有关物质 | 溶液颜色褪至无色所需时间/s | ||||
酸性KMnO4溶液 | H2C2O4溶液 | H2O | |||||
V/mL | c/ mol·L-1 | V mL | c/ mol·L-1 | V/mL | |||
A | 293 | 2 | 0.02 | 4 | 0.1 | 0 | t1 |
B | T1 | 2 | 0.02 | 3 | 0.1 | V1 | 8 |
C | 313 | 2 | 0.02 | V2 | 0.1 | 1 | t2 |
(1)其中V1=_____、T1=_____;通过实验_____(填实验序号)可探究出温度变化对化学反应速率的影响,其中V2=______。
(2)若t1<8,则由此实验可以得出的结论是_____;忽略溶液体积的变化,利用实验B中数据计算,0~8s内,用KMnO4的浓度变化表示的反应速率v(KMnO4)=_______。
(3)该小组的一位同学通过查阅资料发现,上述实验过程中n(Mn2+)随时间的变化情况如图所示,并认为造成这种变化的原因是反应体系中的某种粒子对KMnO4与草酸之间的反应有某种特殊作用,则该作用是_______。