题目内容
【题目】已知NA是阿伏加德罗常数的值,下列说法错误的是( )
A.3 g 3He含有的中子数为1NA
B.1 L 0.1 mol·L1磷酸钠溶液含有的![]() 数目为0.1NA
数目为0.1NA
C.1 mol K2Cr2O7被还原为Cr3+转移的电子数为6NA
D.常温下,11g CO2所含的共用电子对数目为NA
【答案】B
【解析】
A. 3He的中子数为3-2=1,则3g3He的中子数为3g÷3g/mol×NA/mol=1NA,故A正确;
B. 磷酸钠为强碱弱酸盐,磷酸根离子在水溶液中会发生水解,则1 L 0.1 mol·L1的磷酸钠溶液中磷酸根离子的个数小于1 L× 0.1 mol·L1×NA =0.1NA,故B错误;
C. 重铬酸钾被还原为铬离子时,铬元素从+6降低到+3。1mol重铬酸钾中含2molCr原子,故转移的电子数为1mol×2×3×NA/mol=6NA,故C正确;
D. 常温下,11g CO2所含的共用电子对数目为11g÷44g/mol×4×NA /mol= NA,故 D正确;
故选:B。

 高效智能课时作业系列答案
高效智能课时作业系列答案 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案【题目】CO2 和CH4是常见的化合物,同时也是常用的化工原料。
Ⅰ.以CO2与NH3为原料可以合成尿素[CO(NH2)2]。合成尿素的反应为2NH3(g) + CO2(g) ![]() CO(NH2)2(s) + H2O(g)。
CO(NH2)2(s) + H2O(g)。
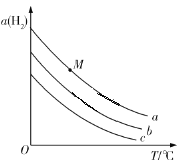
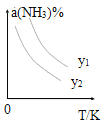
(1)在不同温度及不同y值下合成尿素,达到平衡时,氨气转化率变化情况如图所示。
①该反应的ΔH_____0(填“>” 或、“<” ),该反应自发进行的条件是_______________ (填“低温”“高温”或“任意温度”) 若y表示反应开始时的氨碳比[![]() ],则y1________y2。(填“>”、“<”或“=”);
],则y1________y2。(填“>”、“<”或“=”);
(2)t℃时,若向容积固定的密闭容器中加入一定量的 NH3和CO2合成尿素,下列叙述能说明此反应达到平衡状态的是________ (填字母)。
a.混合气体的平均相对分子质量保持不变
b.CO2和NH3的体积分数保持不变
c.CO2和NH3的转化率相等
d.混合气体的密度保持不变
e.1molCO2生成的同时有 2molN—H键断裂
II.工业上用CH4与水蒸气在一定条件下制取H2,:CH4(g) + H2O(g) ![]() CO(g) + 3H2(g) ΔH = + 203 kJmol-1
CO(g) + 3H2(g) ΔH = + 203 kJmol-1
①该反应逆反应速率表达式为:v逆=kc(CO) c3(H2),k 为速率常数,在某温度下测得实验数据如表:
CO浓度(molL-1) | H2浓度(molL-1) | 逆反应速率(molL-1min-1) |
0.05 | c1 | 4.8 |
c2 | c1 | 19.2 |
c2 | 0.1 | 8.1 |
由上述数据可得该温度下,该反应的逆反应速率常数k为____L3mol-3min-1。
②某温度下,在体积为3 L的密闭容器中通入物质的量均为3 mol的CH4和水蒸气,发生上述反应,5分钟时达到平衡,此时H2的体积分数为60%,则在5分钟内用CH4浓度变化表示的平均反应速率v(CH4)=________;该温度下该反应的平衡常数K=________。平衡后再向容器中加入1 mol CH4和1 mol CO,平衡_______移动(填“正反应方向”或“逆反应方向”或“不”)。
III.在常温下,将0.02mol CO2通入200mL 0.15mol/L的/span>NaOH溶液中,充分反应后下列关系式中正确的是_____________________
A.c(Na+)>c(HCO3-)> c(CO32-)>c(OH-)>c(H+)
B.3c (Na+)=2[c(CO32-)+ c(HCO3-)+ c(H2CO3)]
C.c (Na+)+c(H+)=c(HCO3-)+ c(CO32-)+c(OH-)
D.c(HCO3-)+ 3c(H2CO3)+2c(H+)= c(CO32-)+2c(OH-)