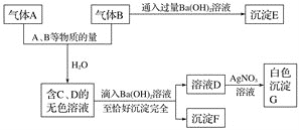
题目内容
【题目】用CO合成甲醇(CH3OH)的化学方程式为CO(g)+2H2(g)CH3OH(g) ΔH<0,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图所示。下列说法正确的是 ( )
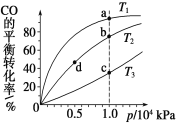
A.温度:T1>T2>T3
B.正反应速率:v(a)>v(c) v(b)>v(d)
C.平均摩尔质量:M(a)>M(c) M(b)>M(d)
D.平衡常数:K(a)<K(c) K(b)=K(d)
【答案】C
【解析】
由CO(g)+2H2(g)CH3OH(g) ΔH<0可知,增大压强,平衡正向移动,升高温度,平衡逆向移动。
A.由图可知,压强相同时,T1→T2→T3,CO的平衡转化率减小,说明T1→T2→T3时,平衡逆向移动,结合分析可知,T1→T2→T3为升高温度,即温度:T1<T2<T3,A错误;
B.a、c压强相同,T1<T3,则v(a)<v(c),b、d温度相同,b点压强大于d点,则v(b)>v(d),B错误;
C.投料比相同时,CO的转化率越高,体系中CH3OH(g)的含量越高,平均摩尔质量越大,故平均摩尔质量:M(a)>M(c),M(b)>M(d),C正确;
D.温度相同时,平衡常数相等,即K(b)=K(d),温度不同时,CO的转化率越大,K越大,即K(a)>K(c),D错误。
答案选C。

练习册系列答案
相关题目
【题目】下图是古丝绸之路中的重要贸易商品,下列有关说法错误的是
|
|
|
|
瓷器 | 丝绸 | 茶叶 | 酒 |
A.陶瓷由黏土经高温烧结而成,其主要成分是硅酸盐
B.丝绸的化学成分主要是纤维素,纤维素属于天然有机高分子化合物
C.茶叶中含多种酚类物质,经常饮用可抗氧化、防衰老
D.我国劳动人民很早就掌握了酿酒技术,但自酿酒中可能会含有甲醇等有害物质,不建议直接饮用