题目内容
【题目】常温下,向20.00 mL 0.100 mol·L-1 CH3COONa溶液中逐滴加入0.100 0 mol·L-1盐酸,溶液的pH与所加盐酸体积的关系如下图所示(不考虑挥发)。下列说法正确的是

A. 点①所示溶液中:c(CH3COOH)=c(Cl-)>c(OH-)=c(H+)
B. 点②所示溶液中:c(Na+)>c(Cl-)>c(CH3COO-)>c(CH3COOH)
C. 点③所示溶液中:c(CH3COOH)>c(Na+)>c(H+)>c(CH3COO-)
D. 整个过程中可能出现:c(H+)+c(Na+)=c(CH3COOH)+c(CH3COO-)
【答案】A
【解析】A项,根据电荷守恒判断;B项,点②溶液正好是NaCl、CH3COONa和CH3COOH等量混合,大小顺序应为c(Na+)>c(CH3COO-)>c(Cl-)>c(CH3COOH);C项,点③正好生成NaCl和CH3COOH溶液,溶液呈酸性,错误;D项,c(H+)+c(Na+)=c(OH-)+c(Cl-)+c(CH3COO-)恒成立,而c(Cl-)+c(OH-)>c(CH3COOH),错误。

 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案【题目】某兴趣小组依据Mg与CO2的反应。推测Mg 与SO2在隔绝空气的条件下反应后,剩余固体M可能含有MgO、S、MgS、Mg中的一种或几种。为了验证推测,进行以下实验。请回答有关问题。
实验一:按如图所示进行实验。
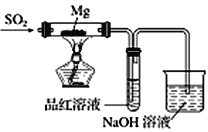
(1)实验室制取二氧化硫的化学方程式为 _________________________________。
(2)上述装置存在不合理之处,请提出一项改进建议 :___________________________。
(3)实验时,先通入SO2直到_______现象出现后,再点燃酒精灯;此操作目的是__________________。
实验二 确定固体M的成分。
实验装置如下图所示。将分液漏斗中稀硫酸(足量)加入到烧瓶中,完全反应后,实验现象如下: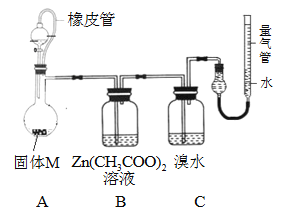
装置 | A | B | C | 量气管 |
现象 | 有残留固体 | 产生白色ZnS沉淀 | 溴水未褪色 | 进入气体v mL(标况) |
(4)实验时,B装置中反应的化学方程式为 __________________________________。
(5)已知镁的相对原子质量为24,则固体M中金属镁的质量为 _________g;实验前装置内有空气,对金属镁质量的测定结果的影响是 ____________(填“偏低”、“偏高”、“无影响”);
(6)依据以上实验,可确定固体M的成分有_________种(填数字)。