题目内容
【题目】某实验小组用0.50 mol·L-1 NaOH溶液和0.50 mol·L-1硫酸溶液进行中和热的测定,其实验装置如图所示.
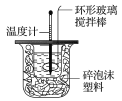
(1)写出该反应的热化学方程式(中和热为57.3 kJ·mol-1):___________________________________。
(2)取50 mL NaOH溶液和30 mL硫酸溶液进行实验,实验数据如下表。请填写下表中的空白:
温度 实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | 温度差平均值(t2-t1)/℃ | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 30.1 | _____ |
2 | 27.0 | 27.4 | 27.2 | 31.2 | |
3 | 25.9 | 25.9 | 25.9 | 29.8 | |
4 | 26.4 | 26.2 | 26.3 | 30.4 | |
(3)近似认为0.50 mol·L-1 NaOH溶液和0.50 mol·L-1硫酸溶液的密度都是1 g·cm-3,中和后生成溶液的比热容c=4.18 J·g-1·℃-1。则中和热ΔH=________________________(取小数点后一位)。
(4)上述实验数值结果与57.3 kJ·mol-1有偏差,产生偏差的原因可能是____________(填字母)。
a 实验装置保温、隔热效果差
b 量取NaOH溶液的体积时仰视读数
c 分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d 用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
【答案】H2SO4(aq)+2NaOH(aq)===Na2SO4(aq)+2H2O(l) ΔH=-114.6 kJ·mol-1 4.0 -53.5 kJ·mol-1 acd
【解析】
(1)依据中和热是强酸和强碱的稀溶液完全反应生成1mol水放出的热量,标注物质聚集状态和对应焓变写出热化学方程式;
(2)先计算出每次试验操作测定的温度差,然后舍弃误差较大的数据,最后计算出温度差平均值;
(3)根据Q=mc△T计算出反应放出的热量,然后计算出生成1mol水放出的热量,就可以得到中和热;
(4)a.装置保温、隔热效果差,测得的热量偏小;
b.量取NaOH溶液的体积时仰视读数,会导致所量的氢氧化钠体积偏大,放出的热量偏高;
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中,热量散失较多;
d.温度计测定NaOH溶液起始温度后直接插入稀H2SO4测温度,硫酸的起始温度偏高。
(1)中和热为57.3kJmol-1,而中和热是强酸和强碱的稀溶液完全反应生成1mol水放出的热量,稀硫酸和稀氢氧化钠溶液反应的热化学方程式为:H2SO4(aq)+2NaOH(aq)===Na2SO4(aq)+2H2O(l) ΔH=-114.6 kJ·mol-1;
(2)第一次测定温度差为:(30.1-26.1)℃=4.0℃,第二次测定的温度差为:(31.2-27.2)℃=4.0℃,第三次测定的温度差为:(29.8-25.9)℃=3.9℃,第四次测定的温度差为:(30.4-26.3)℃=4.1℃,四次温度差的平均值为4.0℃;
(3)50mL0.50mol/L氢氧化钠与30mL0.50mol/L硫酸溶液进行中和反应,生成水的物质的量为0.05L×0.50mol/L=0.025mol,溶液的质量为:80mL×1g/cm3=100g,温度变化的值为△T=4.0℃,则生成0.025mol水放出的热量为:Q=mc△T=80g×4.18J/(g℃)×4.0℃=1337.6J,即1.3376KJ,所以实验测得的中和热△H=-![]() =-53.5kJ/mol;
=-53.5kJ/mol;
(4)a.装置保温、隔热效果差,测得的热量偏小,中和热的数值偏小,故a正确;
b.量取NaOH溶液的体积时仰视读数,会导致所量的氢氧化钠体积偏大,放出的热量偏高,中和热的数值偏大,故b错误;
c.分多次把NaOH 溶液倒人盛有硫酸的小烧杯中,热量散失较多,测得温度偏低,中和热的数值偏小,故c正确;
d.温度计测定NaOH溶液起始温度后直接插入稀H2SO4测温度,硫酸的起始温度偏高,温度差偏小,测得的热量偏小,中和热的数值偏小,故d正确.
故答案为:acd。

 名校课堂系列答案
名校课堂系列答案【题目】实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持、加热和净化装置)。仅用此装置和表中提供的物质完成相关实验,最合理的选项是
选项 | a中的物质 | b中的物质 | c中收集的气体 | d中的物质 |
A | 浓硝酸 | Cu | NO2 | NaOH溶液 |
B | 浓氨水 | CaO | NH3 | H2O |
C | 稀硝酸 | Cu | NO | H2O |
D | 浓硫酸 | Cu | SO2 | 饱和NaHSO3溶液 |
A.AB.BC.CD.D