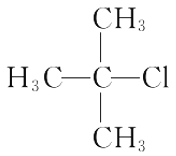
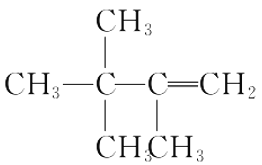
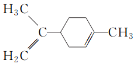
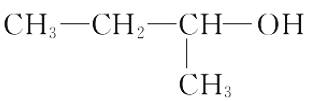题目内容
【题目】实验室配制500 mL 0.5 mol·L-1的NaCl溶液,有如下操作步骤:
①把称量好的NaCl晶体放入小烧杯中,加适量蒸馏水溶解;
②把①所得溶液小心转入500 mL容量瓶中;
③继续向容量瓶中加蒸馏水至液面距离刻度线l~2 cm处,改用胶头滴管小心滴加蒸馏水至溶液凹液面底部,与刻度线相切;
④用少量蒸馏水洗涤烧杯和玻璃棒2~3次,每次洗涤的液体都小心转入容量瓶,并轻轻摇匀;
⑤将容量瓶塞紧,反复上下颠倒摇匀。
请填写下列空白:
(1)实验操作步骤的正确顺序为(填序号) _______________________;
(2)配制过程中使用的仪器除托盘天平、烧杯、玻璃棒、量筒、胶头滴管外,还必须用到的玻璃仪器有 ______________________;
(3)实验中称取NaCl晶体的质量是_________________g;
(4)若出现如下情况,对所配溶液浓度将有何影响?(填“偏高”、“偏低”、“无影响”)
A、定容时俯视 _______________;
B、加蒸馏水时不慎超过了刻度 线________________。
【答案】① ② ④ ③ ⑤ 500mL容量瓶 14.6 g 偏高 偏低
【解析】
(1)根据实验操作的步骤:计算→称量→溶解、冷却→移液→洗涤→定容→摇匀→装瓶贴签;
(2)根据实验操作的步骤:计算→称量→溶解、冷却→移液→洗涤→定容→摇匀→装瓶贴签以及每步操作需要仪器确定实验所需仪器;
(3)根据m=cVM计算NaCl的质量以及天平的精确度为0.1g来称取NaCl的质量;
(4)根据c=![]() 分析操作对溶质的物质的量或对溶液的体积的影响判断;
分析操作对溶质的物质的量或对溶液的体积的影响判断;
(1)实验操作的步骤:计算→称量→溶解、冷却→移液→洗涤→定容→摇匀→装瓶贴签,故答案为:①②④③⑤;
(2)实验操作的步骤:计算→称量→溶解、冷却→移液→洗涤→定容→摇匀→装瓶贴签,一般用天平称量(用到药匙)称量,在烧杯中溶解(可用量筒量取水,用玻璃棒搅拌加速溶解),冷却后转移到500mL容量瓶中,并用玻璃棒引流,转移完毕,用少量蒸馏水洗涤烧杯及玻璃棒2~3次并将洗涤液全部转移到容量瓶中,再加适量蒸馏水,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,使溶液的凹液面的最低点与刻线相平,塞好瓶塞,反复上下颠倒摇匀,所以需要的仪器有托盘天平、药匙、烧杯、量筒、玻璃棒、500mL容量瓶、胶头滴管,本实验用到的基本仪器中除托盘天平、烧杯、量筒、玻璃棒、胶头滴管外,还需要的玻璃仪器为500mL容量瓶;
故答案为:500mL容量瓶
(3)500mL 0.5molL-1的NaCl溶液,需要NaCl的质量0.5mol/L×0.5L×58.5g/mol=14.625g,天平的精确度为0.1g,所以称取NaCl晶体的质量是14.6g;
故答案为:14.6;
(4)A、定容时俯视,溶液的液面低于刻度线,导致溶液的体积偏小,根据c=![]() 分析可知溶液浓度偏高,故答案为:偏高;
分析可知溶液浓度偏高,故答案为:偏高;
B、加蒸馏水时不慎超过了刻度,导致溶液的体积偏大,根据c=![]() 分析可知,溶液浓度偏低,故答案为:偏低。
分析可知,溶液浓度偏低,故答案为:偏低。

 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案【题目】某实验小组用0.50 mol·L-1 NaOH溶液和0.50 mol·L-1硫酸溶液进行中和热的测定,其实验装置如图所示.
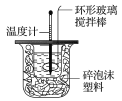
(1)写出该反应的热化学方程式(中和热为57.3 kJ·mol-1):___________________________________。
(2)取50 mL NaOH溶液和30 mL硫酸溶液进行实验,实验数据如下表。请填写下表中的空白:
温度 实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | 温度差平均值(t2-t1)/℃ | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 30.1 | _____ |
2 | 27.0 | 27.4 | 27.2 | 31.2 | |
3 | 25.9 | 25.9 | 25.9 | 29.8 | |
4 | 26.4 | 26.2 | 26.3 | 30.4 | |
(3)近似认为0.50 mol·L-1 NaOH溶液和0.50 mol·L-1硫酸溶液的密度都是1 g·cm-3,中和后生成溶液的比热容c=4.18 J·g-1·℃-1。则中和热ΔH=________________________(取小数点后一位)。
(4)上述实验数值结果与57.3 kJ·mol-1有偏差,产生偏差的原因可能是____________(填字母)。
a 实验装置保温、隔热效果差
b 量取NaOH溶液的体积时仰视读数
c 分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d 用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度