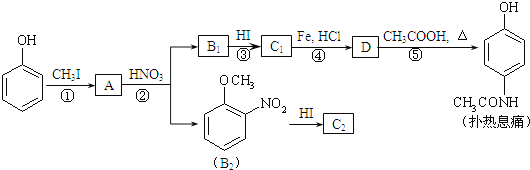
题目内容
【题目】任何一个化学反应中都会伴随能量变化和物质变化。
(1)下图为氢气和氧气生成1mol水蒸气时的能量变化情况。
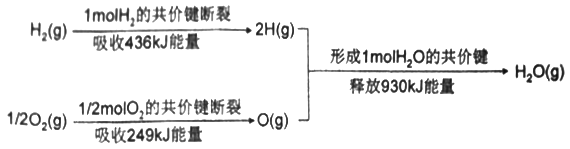
生成1mol水蒸气时,形成新化学键所释放的总能量_____断开旧化学键所吸收的总能量(填“大于”“小于”或“等于”),因此水的分解反应为________(填“吸热”或“放热”)反应。
(2)随着科学技术的发展和社会进步,各种各样的电器不断进入现代社会,化学电源大大丰富和方便了我们的生活、学习和工作。原电池中发生的化学反应属于______。镁铝原电池,电解质用稀硫酸,则其负极的电极反应式为______;电解质用氢氧化钠溶液,电池工作时,溶液中的OH-移向_____极(“镁”或“铝”)。
(3)在三个容器均为2L的密闭容器中发生反应:2HI(g) ![]() H2(g)+I2(g),已知H2(g)和I2(g)的起始物质的量均为0,HI(g)的物质的量(mol)随反应时间(min)的变化情况如下表所示,表中温度的单位为摄氏度(℃)。
H2(g)+I2(g),已知H2(g)和I2(g)的起始物质的量均为0,HI(g)的物质的量(mol)随反应时间(min)的变化情况如下表所示,表中温度的单位为摄氏度(℃)。
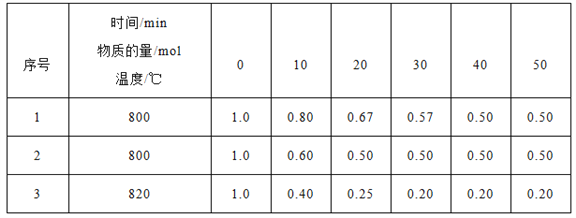
①实验1和实验2中,有一个实验使用了催化剂,则使用了催化剂的是实验_____(填“1”或“2”)。
②实验1中,20min~30min间生成I2(g)的平均反应速率为_____,实验3的反应达到化学反应限度时H2(g)物质的量的百分数为_______。
③下列物理量不再变化时,能判断实验3中反应达到化学反应限度的是__________。
A.混合气体颜色 B.混合气体密度 C.混合气体总压强
【答案】 大于 吸热 (自发的)氧化还原反应 Mg-2e-=Mg2+ 铝 2 0.0025mol/(L·min) 0.40或40% A
【解析】(1)根据示意图可知生成1mol水蒸气时放热,因此形成新化学键所释放的总能量大于断开旧化学键所吸收的总能量,因此水的分解反应为吸热反应。(2)原电池中发生的化学反应属于(自发的)氧化还原反应。镁铝原电池,电解质用稀硫酸,镁的金属性强于铝,镁是负极,则其负极的电极反应式为Mg-2e-=Mg2+;电解质用氢氧化钠溶液,铝能与氢氧化钠溶液反应,因此电池工作时铝是负极,溶液中的OH-移向铝极。(3)①根据表中数据可知实验2中达到平衡的时间少,说明使用了催化剂。②实验1中,20min~30min间内消耗HI是0.67mol-0.57mol=0.1mol,则生成碘是0.05mol,浓度是0.05mol÷2L=0.025mol/L,则生成I2(g)的平均反应速率为0.025mol/L÷10min=0.0025mol/(L·min);实验3的反应达到化学反应限度时HI是0.2mol,消耗HI是0.8mol,则生成H2(g)物质的量为0.4mol,反应前后体积不变,则氢气的百分数为0.4mol/1mol×100%=40%。③A.混合气体颜色即说明碘的浓度不再发生变化,反应达到平衡状态,A正确;B.密度是混合气的质量和容器容积的比值,在反应过程中质量和容积始终是不变的,混合气体密度始终不变,B错误;C.混合气的总的物质的量不变,压强始终不变,C错误。答案选A。