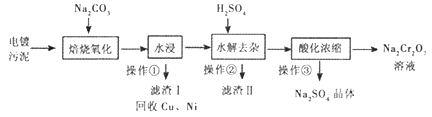
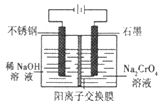
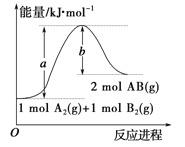
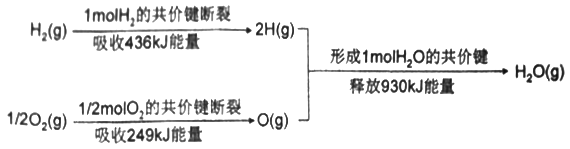
题目内容
【题目】某+2价离子的电子排布式为1s22s22p63s23p63d9 , 该元素在周期表中所属的族是( )
A.ⅡA
B.ⅡB
C.VⅢ
D.ⅠB
【答案】D
【解析】解:某+2价离子的电子排布式为1s22s22p63s23p63d9 , 该元素原子的核外电子电子排布式为1s22s22p63s23p63d104s1 , 处于周期表中ds区,最外层电子数为族序数,电子层数等于周期数,所以该元素处于第四周期第ⅠB族.
故选:D.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目