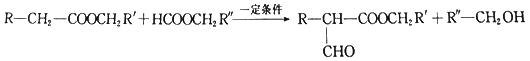
题目内容
【题目】氢能是一种高效清洁、极具发展潜力的能源。利用生物质发酵得到的乙醇制取氢气,具有良好的应用前景。
已知下列反应:
反应I:CH3CH2OH(g)+H2O(g) ![]() 2CO(g)+4H2(g) △H1
2CO(g)+4H2(g) △H1
反应Ⅱ:CO(g)+ H2O(g) ![]() CO2(g)+ H2(g) △H2
CO2(g)+ H2(g) △H2
反应Ⅲ:2 CO2(g)+ 6H2(g) ![]() CH3CH2OH(g)+3H2O(g) △H3
CH3CH2OH(g)+3H2O(g) △H3
反应Ⅳ:6H2(g)+2CO2(g) ![]() CH2=CH2(g)+4H2O(g) △H4
CH2=CH2(g)+4H2O(g) △H4
(1)反应I和反应II的平衡常数随温度变化曲线如图所示。则△H1 _________△H2(填“>”、“<”或“=”);△H3=_________(用△H1、△H2表示)。

(2)向2L密闭容器中充入H2和CO2共6mol,改变氢碳比[n(H2)/n(CO2)]在不同温度下发生反应III达到平衡状态,测得的实验数据如下表。分析表中数据回答下列问题:
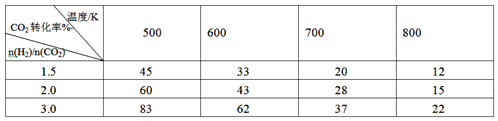
①温度升高,K值__________(填“增大”、“减小”、或“不变”)。
②提高氢碳比,K值____(填“增大”、“减小”、或“不变”),对生成乙醇______(填“有利”或“不利”)。
③在700K、 氢碳比为1.5,若5min反应达到平衡状态,则0~5min用H2表示的速率为__________。
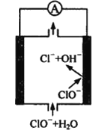
(3)反应III在经CO2饱和处理的KHCO3电解液中,电解活化CO2制备乙醇的原理如图所示。
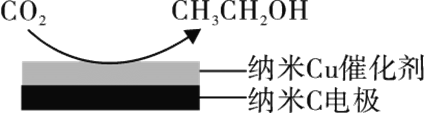
①阴极的电极反应式为________。
②从电解后溶液中分离出乙醇的操作方法为________。
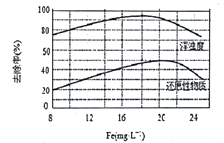
(4)在一定条件下发生反应Ⅳ,测得不同温度对CO2的平衡转化率及催化剂的效率影响如图所示,下列有关说法正确的为________(填序号)。
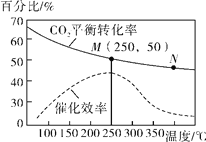
①不同条件下反应,N点的速率最大
②M点平衡常数比N点平衡常数大
③温度低于250℃时,随温度升高乙烯的产率增大
④实际反应应尽可能在较低的温度下进行,以提高CO2的平衡转化率。
【答案】 > -(2△H2 + △H1) 减小 不变 有利 0.144mol·L-1·min-1 14CO2 + 12e- + 9H2O = CH3CH2OH + 12HCO3- 蒸馏 ②
【解析】试题分析:由反应I CH3CH2OH(g)+H2O(g) ![]() 2CO(g)+4H2(g) △H1;反应Ⅱ CO(g)+ H2O(g)
2CO(g)+4H2(g) △H1;反应Ⅱ CO(g)+ H2O(g) ![]() CO2(g)+ H2(g) △H2;反应Ⅲ 2 CO2(g)+ 6H2(g)
CO2(g)+ H2(g) △H2;反应Ⅲ 2 CO2(g)+ 6H2(g) ![]() CH3CH2OH(g)+3H2O(g) △H3;反应Ⅳ 6H2(g)+2CO2(g)
CH3CH2OH(g)+3H2O(g) △H3;反应Ⅳ 6H2(g)+2CO2(g) ![]() CH2=CH2(g)+4H2O(g) △H4可知,根据盖斯定律,由(Ⅱ
CH2=CH2(g)+4H2O(g) △H4可知,根据盖斯定律,由(Ⅱ![]() +Ⅰ)
+Ⅰ)![]() 可得反应Ⅲ,所以,H3=-(2△H2 + △H1)。
可得反应Ⅲ,所以,H3=-(2△H2 + △H1)。
(1)由反应I和反应II的平衡常数随温度变化曲线可知,反应I的平衡常数随温度升高而增大,反应II的平衡常数随温度升高而减小,所以,△H1>0,△H2<0,△H1 >△H2;△H3=-(2△H2 + △H1)。
(2)试题分析:由表中数据可知,在氢碳比一定的条件下,CO2的平衡转化率随温度升高而减小,故该反应是放热反应,其平衡常数随温度升高而减小,平衡常数只与温度有关,温度不变则其值不变。在温度相同的条件下,CO2的平衡转化率随氢碳比的增大而增大。①温度升高,K值减小。②提高氢碳比,K值不变,对生成乙醇有利。
③由表中数据可知,在700K、 氢碳比为1.5,即起始投入3.6molH2和2.4mol CO2,CO2的平衡转化率为20%,则CO2的变化量为0.48mol,H2的变化量为1.44mol,若5min反应达到平衡状态,则0~5min用H2表示的速率为![]() 0.144mol·L-1·min-1。
0.144mol·L-1·min-1。
(3)由CO2制备乙醇的反应是一个还原反应,故该反应在阴极上发生。①阴极的电极反应式为14CO2 + 12e- + 9H2O = CH3CH2OH + 12HCO3-。
②电解后溶液中含有碳酸氢钠和乙醇,可以根据各组分的沸点相差较大分离出乙醇,故从其中分离出乙醇的操作方法为蒸馏。
(4)由图可知:①不同条件下反应,M点催化效率最高,故M点的速率最大;②CO2的平衡转化率随温度升高而减小,故M点平衡常数比N点平衡常数大;③温度低于250℃时,CO2的平衡转化率随温度升高而减小,故随温度升高乙烯的产率减小;④实际反应应在250℃左右进行,在此温度下催化剂的催化效率离高、化学反应速率最快、CO2的平衡转化率较高,故生产效率较高。综上所述,有关说法正确的为②。

【题目】低温迫使植物细胞产生大量对细胞有害的过氧化物,如脂质过氧化物(MDA)。超氧化物歧化酶(SOD)能够消除过氧化物,从而增强植物的抗冷性。研究人员进行了“水杨酸对水稻幼苗抗冷性的影响”实验,实验步骤及结果如表所示。
组别 | 处理 | 培养温度 /℃ |
|
1 | 蒸馏水浇灌 | 25 | 7.3 |
2 | ① | ② | 9.4 |
3 | 0.5 mmol/L水杨酸浇灌 | 5 | 10.3 |
4 | 1.0 mmol/L水杨酸浇灌 | 5 | 11.6 |
5 | 1.5 mmol/L水杨酸浇灌 | 5 | 13.6 |
6 | 2.0 mmol/L水杨酸浇灌 | 5 | 8.5 |
7 | 2.5 mmol/L水杨酸浇灌 | 5 | 7.9 |
8 | 3.0 mmol/L水杨酸浇灌 | 5 | 6.5 |
(1)表中①是 ,②是 ,其的作用为 ,实验设计时每组取50株水稻幼苗,而不是1株,目的是 。
(2)本实验自变量为 , ,需要控制的无关变量有 , (至少写两个)。
(3)组别1和2对照可得的结论是 。对比组别2~8可得的结论是 。
(4)在5 ℃的环境下,物质的量浓度为2.0 mmol/L的水杨酸对水稻幼苗抗冷性的影响是 (填“增强”或“减弱”)。
(5)请根据5 ℃条件下的实验结果完成水杨酸浓度—SOD活性关系的坐标曲线图。
【题目】已知A(g)+B(g)![]() C(g)+D(g)反应的平衡常数和温度的关系如下:
C(g)+D(g)反应的平衡常数和温度的关系如下:
温度/ ℃ | 700 | 800 | 830 | 1000 | 1200 |
平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
830℃时,向一个2 L的密闭容器中充入0.2mol的A和0.8mol的B,反应初始4 s内A的平均反应速率v(A)=0.005mol/(L·s)。下列说法正确的是
A.4 s时c(B)为0.76mol/L
B.830℃达平衡时,A的转化率为80%
C.反应达平衡后,升高温度,平衡正向移动
D.1200℃时反应C(g)+D(g)![]() A(g)+B(g)的平衡常数的值为0.4
A(g)+B(g)的平衡常数的值为0.4