题目内容
【题目】第四周期中某些元素的相关化合物在化工、医药、材料等领域有着广泛应用
(1)现代化学中,常利用_________上的特征谱线来鉴定元素。Ga的外围电子排布式为:_____________________,基态Ga原子核外有______种运动状态不同的电子。
(2)锗、砷、硒、溴的第一电离能由大到小的顺序为____________(用元素符号表示);其中锗的化合物四氯化锗可用作光导纤维掺杂剂,其熔点为-49.5℃,沸点为83.1℃,则其晶体类型为_________,中心原子的杂化类型为________;砷酸的酸性弱于硒酸,从分子结构的角度解释原因_______________________。
(3)铁能形成[Fe(Bipy)2C12]ClO4等多种配合物(Bipy结构如下图A)。

①该配合物中中心原子的化合价为________;与中心原子形成配位键的原子是________。
②与ClO4-互为等电子体的一种非极性分子是_______(举1例)。
③1 mol Bipy中所含σ键______mol。
(4)钛(Ti)被誉为“21世纪金属”,Ti晶体的堆积方式是六方最密堆积如图B所示,晶胞可用图C表示。设金属Ti的原子半径为a cm,空间利用率为__________。设晶胞中A点原子的坐标为(1,0,0),C点原子的坐标为(0,1,0),D点原子的坐标为(0,0,1),则B点原子的坐标为________________。
【答案】 原子光谱 4s24p1 31 Br>As>Se>Ge 分子晶体 sp3 H2SeO4的非羟基氧原子多,Se的正电性更高,羟基中的O原子的电子向Se偏移程度大,更容易电离出H+ +3 N 、Cl CCl4 (SiF4 等) 8 ![]() 或74% (
或74% (![]() ,
,![]() ,
,![]() )
)
【解析】试题分析:现代化学中,常利用原子光谱上的特征谱线来鉴定元素。原子核外电子的运动状态互不相同,有几个电子,就有几种运动状态。同一周期元素的第一电离能呈逐渐增大趋势,第IIVA和第VA元素因其原子结构较稳定,故其第一电离能高于同周期相邻的两种元素。
(1)现代化学中,常利用原子光谱上的特征谱线来鉴定元素。Ga的外围电子排布式为4s24p1,Ga是31号元素,故基态Ga原子核外有31种运动状态不同的电子。
(2)锗、砷、硒、溴的第一电离能由大到小的顺序为Br>As>Se>Ge;其中锗的化合物四氯化锗可用作光导纤维掺杂剂,其熔点为-49.5℃,沸点为83.1℃,其熔、沸点较低,故其晶体类型为分子晶体,中心原子锗原子形成4个σ键、无孤电子对,故其杂化类型为sp3;砷酸的酸性弱于硒酸,是因为H2SeO4的非羟基氧原子多,Se的正电性更高,羟基中的O原子的电子向Se偏移程度大,更容易电离出H+。
(3)①配合物[Fe(Bipy)2C12]ClO4的外界是ClO4-,内界有Bipy和Cl-两种配体,Bipy是电中性的,所以,中心原子的化合价为+3;两种配体中N和Cl有孤电子对,故与中心原子形成配位键的原子是N和Cl。
②ClO4-有5个原子、32个价电子,与ClO4-互为等电子体的有多种,其中属于非极性分子是CCl4和SiF4 等。
③Bipy分子中有N—N、N—H、N—C、C—H等4种σ键,注意2个C原子上分别连接1个H,故1 mol Bipy中所含σ键8mol。
(4)由Ti晶体的晶胞结构示意图可知,该晶胞为平行六面体,其底是菱形,金属Ti的原子半径为a cm,则底边长为2acm,底面的面积为2a![]() sin60
sin60![]() 。B点与底面连线的3个点构成正四面体,正四面体的高为
。B点与底面连线的3个点构成正四面体,正四面体的高为![]() ,所以晶胞的高为
,所以晶胞的高为![]() ,晶胞的体积为底面的面积与高的积,即
,晶胞的体积为底面的面积与高的积,即![]() ,根据均摊法可以求出该晶胞中有2个Ti原子,2个Ti原子的体积为
,根据均摊法可以求出该晶胞中有2个Ti原子,2个Ti原子的体积为![]() ,所以,原子的空间利用率为
,所以,原子的空间利用率为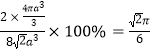 (或74%)。设晶胞中A点原子的坐标为(1,0,0),C点原子的坐标为(0,1,0),D点原子的坐标为(0,0,1),B点的高度为晶胞高度的一半,由B点向底面作垂线,垂足为中线的三等分点,则垂足的坐标为(
(或74%)。设晶胞中A点原子的坐标为(1,0,0),C点原子的坐标为(0,1,0),D点原子的坐标为(0,0,1),B点的高度为晶胞高度的一半,由B点向底面作垂线,垂足为中线的三等分点,则垂足的坐标为(![]() ,0),所以,B点原子的坐标为(
,0),所以,B点原子的坐标为(![]() )。
)。

 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案