题目内容
【题目】FeCl3具有净水作用,但腐蚀设备,而聚合氧化铁是一种新型的絮凝剂,处理污水比FeCl3 高效,且腐蚀性小。请回答下列问题:
(1)FeCl3净水的原理是__________________,FeCl3溶液腐蚀钢铁设备,除H+作用外,另一主要原因是(用离了方程式表示)___________________________。
(2)为节约成本,工业上用NaClO3 氧化酸性FeCl2 废液得到FeCl3。
①若酸性FeCl2溶液中c(Fe2+)=2.0×10-2mol/L,c(Fe3+)=1.0×10-3mol/L,c(Cl-)=5.3×10-2mol/L,则该溶液的pH约为________________。
②完成NaClO3氧化FeCl2的离子方程式:□ClO3-+□Fe2++□___=□Cl-+□Fe3++□____。
(3)FeCl3在溶液中分三步水解:
Fe3++H2O![]() Fe(OH)2++H+ K1
Fe(OH)2++H+ K1
Fe(OH)2++H2O![]() Fe(OH)2++H+ K2
Fe(OH)2++H+ K2
Fe(OH)++H2O![]() Fe(OH)3+H+ K3
Fe(OH)3+H+ K3
以上水解反应的平衡常数K1、K2、K3由大到小的顺序是________________________。
通过控制条件,以上水解产物聚合,生成聚合氧化铁,离子方程式为:xFe3++yH2O![]() Fex(OH)y(3x-y)++yH+
Fex(OH)y(3x-y)++yH+
欲使平衡正向移动可采用的方法是(填序号)___________。
a.降温 b.加水稀释 c.加入NH4Cl d.加入NaHCO3
室温下,使氯化铁溶液转化为高浓度聚合氯化铁的关键条件是_______________________。
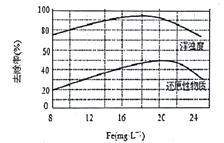
(4)天津某污水处理厂用氯化铁净化污水的结果如图所示。由图中数据得出每升污水中投放聚合氯化铁[以Fe(mg·L-1)表示]的最佳范围约为_________mg·L-1。
【答案】 Fe3+水解生成的Fe(OH)3胶体粒子能吸附水中的悬浮杂质 2Fe3++Fe=3Fe2+ 2 1 6 6H+ 1 6 3H2O K1>K2>K3 b d 调节溶液的pH 18~20
【解析】本题主要考查盐类水解的影响因素。
(1)FeCl3净水的原理是Fe3+水解生成的Fe(OH)3胶体粒子能吸附水中的悬浮杂质,FeCl3溶液腐蚀钢铁设备,除H+作用外,另一主要原因是2Fe3++Fe=3Fe2+。
(2)若酸性FeCl2以液中电荷守恒:2c(Fe2+)+3c(Fe3+)+ c(H+)=c(Cl-)+c(OH-),酸性溶液中可忽略c(OH-),c(H+)=c(Cl-)-2c(Fe2+)-3c(Fe3+)=1.0×10-2mol/L,则该溶液的pH约为2。
②根据电子守恒初步将方程式配平为ClO3-+6Fe2++□___=Cl-+6Fe3++□____。再根据溶液呈酸性、电荷守恒和元素守恒得到完整方程式:ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O。
(3)FeCl3的分步水解程度越来越小,所以K1>K2>K3。
欲使平衡正向移动可采用的方法是bd。a.盐类水解为吸热反应,降温平衡左移,故a不符合题意;b.加水稀释促进盐类水解,故b符合题意;c.NH4Cl 的水解抑制上述水解,故c不符合题意;d.NaHCO3的水解促进上述水解,故d符合题意。故选bd。
分析离子方程式:xFe3++yH2O![]() Fex(OH)y(3x-y)++yH+可知室温下,使氯化铁溶液转化为高浓度聚合氯化铁的关键条件是调节溶液的pH。
Fex(OH)y(3x-y)++yH+可知室温下,使氯化铁溶液转化为高浓度聚合氯化铁的关键条件是调节溶液的pH。
(4)由图中数据得出每升污水中投放聚合氯化铁[以Fe(mg·L-1)表示]的最佳范围约为18~20mg·L-1。