题目内容
【题目】镁—次氯酸盐燃料电池具有比能量高、安全方便等优点,该电池主要工作原理如图所示,其正极反应为:ClO- + H2O + 2e- = Cl- + 2OH-,关于该电池的叙述正确的是
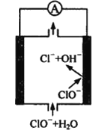
A.该电池中镁为负极,发生还原反应
B.电池工作时,OH-向正极移动
C.电池工作时,正极周围溶液的pH将不断变小
D.该电池的总反应为:Mg + ClO- + H2O = Mg(OH)2↓+ Cl-
【答案】D
【解析】
试题分析:A.该电池中镁为负极,发生氧化反应.Mg-2e-+ 2OH-= Mg(OH)2↓。错误. B.根据同种电荷相互排斥,异种电荷相互吸引的原则,在电池工作时,OH-向正电荷较多的负极移动。错误。C.在电池工作时,由于正极发生反应为:ClO- + H2O + 2e- = Cl- + 2OH-,所以正极周围溶液的pH将不断变大。错误。D.根据正极、负极的电极反应式可知该电池的总反应为:Mg + ClO- + H2O = Mg(OH)2↓+ Cl-。正确。

练习册系列答案
 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案
相关题目