题目内容
科学家最近用金属钠还原CCl4和SiCl4制得一种一维SiC纳米捧。相关反应的化学方程式为:8Na+CCl4十SiCl4=SiC十8NaCl。下列说法不正确的是( )
| A.一维SiC纳米棒“比表面积”大,对微小粒子有较强的吸附能力 |
| B.上述反应中SiC既是氧化产物又是还原产物 |
| C.SiCl4是由极性键构成的非极性分子 |
| D.CCl4分子、SiCl4分子、SiC晶体中各原子都达到了8电子稳定结构 |
B
解析试题分析:A.一维SiC纳米棒将物质制成纳米颗粒的大小,所以“比表面积”大,具有强的吸附力,可以对微小粒子有较强的吸附能力。正确。B. SiC中的C由反应前CCl4的化合价为+4价变为反应后SiC中的-4价,化合价升高是氧化产物,而Si的化合价在反应前后没有变化。因此SiC只是氧化产物。错误。C.SiCl4是由4个极性键Si—Cl结合而成的正四面体结构,键角109°28′。由于各个化学键排列对称,因此构成的非极性分子。正确。D.由个元素原子的结构及原子的结合方式可知CCl4分子、SiCl4分子、SiC晶体中各原子都达到了8电子稳定结构。正确。
考点:考查胶体的性质、分子结构、氧化还原反应的概念的知识。

在一定条件下,氯气与碘单质以等物质的量进行反应,可得到一种红棕色液体ICl,ICl有很强的氧化性。现有下列两个反应:①2ICl+2Zn= ZnCl2+ZnI2;②ICl+H2O=HCl+HIO。下列关于ICl性质的叙述正确的是
| A.反应①中,当转移0.4mol电子时生成13.6gZnCl2; |
| B.反应①中,ZnCl2是氧化产物,ZnI2是还原产物 |
| C.反应①中,ZnCl2既是氧化产物又是还原产物; |
| D.反应②中,ICl既是氧化剂又是还原剂 |
CuSO4溶液中加入过量KI溶液,产生白色CuI沉淀,溶液变棕色。向反应后溶液中通入过量SO2,溶液变成无色。下列说法不正确的是
| A.滴加KI溶液时,KI被氧化,CuI是还原产物 |
| B.通入SO2后,溶液变无色,体现SO2的还原性 |
| C.整个过程发生了复分解反应和氧化还原反应 |
| D.上述实验条件下,物质的氧化性:Cu2+>I2>SO2 |
下列是海水综合应用中提取镁、溴的反应,属非氧化还原反应的是
| A.苦卤中加入石灰乳MgCl2+ Ca(OH)2 = CaCl2 +Mg(OH)2 |
| B.苦卤中通入氯气2Br- + Cl2 = 2Cl- + Br2 |
C.氯碱工业电解食盐水2NaCl + 2H2O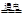 2NaOH + H2↑+ Cl2↑ 2NaOH + H2↑+ Cl2↑ |
D.电解氯化镁MgCl2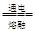 Mg + Cl2↑ Mg + Cl2↑ |
某金属和硝酸反应,已知参加反应的被还原的硝酸和参加反应的硝酸的物质的量之比为1∶6,若已知还原产物唯一,则还原产物为
| A.N2 | B.N2O | C.NO | D.NO2 |
钢铁“发蓝”是将钢铁制品浸到某些氧化性的溶液中,在钢铁的表面形成一层四氧化三铁的技术过程。其中一种办法是将钢铁制品浸到亚硝酸钠和浓氢氧化钠的混合溶液中加热到130 ℃反应。其过程可以用如下化学方程式表示:
①3Fe+NaNO2+5NaOH=3Na2FeO2+H2O+NH3↑
②6Na2FeO2+NaNO2+=5H2O3Na2Fe2O4+NH3↑+7NaOH
③Na2FeO2+Na2Fe2O4+2H2O=Fe3O4+4NaOH下列说法正确的是( )。
| A.反应①不是氧化还原反应 |
| B.该生产过程不产生任何污染 |
| C.整个反应过程中,每有5.6 g Fe参加反应转移0.8 mol电子 |
| D.反应②中的氧化剂是NaNO2 |
已知:
①向KMnO4晶体中滴加浓盐酸,产生某黄绿色气体;
②向FeCl2溶液中通入少量实验①产生的气体,溶液变黄色;③取实验②生成的溶液滴在淀粉KI试纸上,试纸变蓝色。
下列判断中正确的是( )
| A.①中产生气体的电子式是Cl?Cl |
| B.上述实验中,共有两个氧化还原反应 |
| C.实验②中FeCl2被氧化 |
| D.实验③发生的是同主族元素单质间的置换反应 |