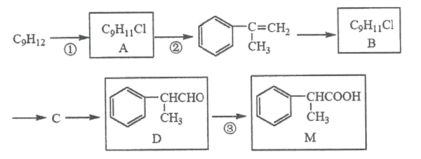
题目内容
【题目】某校化学学习小组设计了相关实验来探究元素周期律。该组同学为验证卤素单质氧化性的相对强弱,用如图所示装置进行实验(夹持仪器已略去,气密性已检验)。
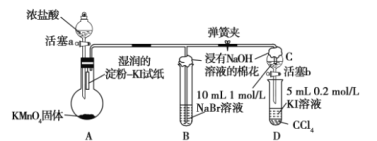
实验过程及现象:
Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸;
Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹;
Ⅲ.当B中溶液由黄色变为棕红色时,关闭活塞a;
Ⅳ.打开活塞b,将少量C中溶液滴入D中,关闭活塞b,取下D振荡,静置后![]() 层溶液变为紫红色。
层溶液变为紫红色。
请回答下列有关问题。
(1)B中溶液由黄色变为棕红色时发生反应的离子方程式为______。
(2)验证氯气的氧化性强于碘的实验现象是______。
(3)B和C仪器口放置浸有![]() 溶液的棉花的作用是______。
溶液的棉花的作用是______。
(4)由此实验得出的结论:同主族元素从上到下,原子的得电子能力逐渐______(填“减弱”或“增强”)。
【答案】![]() 湿润的淀粉
湿润的淀粉![]() 试纸变蓝 吸收未反应的氯气,防止污染空气 减弱
试纸变蓝 吸收未反应的氯气,防止污染空气 减弱
【解析】
浓盐酸和高锰酸钾反应生成氯气,氯气使湿润淀粉-KI试纸变蓝,氯气与溴化钠反应生成溴单质和氯化钠。将C中生成的单质溴加入到D中,把碘化钾氧化为单质碘,由于氯气会向外扩散,因此在试管口要用浸有![]() 溶液的棉花,主要是除掉氯气,防止污染环境。
溶液的棉花,主要是除掉氯气,防止污染环境。
(1)![]() 与
与![]() 溶液反应生成
溶液反应生成![]() 和
和![]() ,反应的离子方程式为
,反应的离子方程式为![]() ;故答案为:
;故答案为:![]() 。
。
(2)湿润的淀粉![]() 试纸变蓝色,说明有单质碘生成,即说明氯气的氧化性强于碘;故答案为:湿润的淀粉
试纸变蓝色,说明有单质碘生成,即说明氯气的氧化性强于碘;故答案为:湿润的淀粉![]() 试纸变蓝。
试纸变蓝。
(3)B和C仪器口放置浸有![]() 溶液的棉花的作用是吸收未反应的氯气,防止其对空气造成污染;故答案为:吸收未反应的氯气,防止污染空气。
溶液的棉花的作用是吸收未反应的氯气,防止其对空气造成污染;故答案为:吸收未反应的氯气,防止污染空气。
(4)由实验可知氯气的氧化性强于溴,而溴的氧化性强于碘,所以同主族元素从上到下,原子的得电子能力逐渐减弱;故答案为:减弱。

【题目】已知X、Y、Z、W为原子序数依次增大的四种短周期主族元素,前三种元素原子的电子层数相同,Y、W元素原子的最外层电子数相同。表给出了四种元素的部分信息,则下列说法正确的是
元素 | X | Y | Z | W |
原子半径/nm | 0.134 | r1 | r2 | 0.106 |
A.r1>r2>0.106
B.0.134<r1<r2
C.0.134>r1>r2
D.电子层数多的元素的原子半径一定比较大