题目内容
【题目】常温下,分别向1L0.1mol·L-1MgCl2和MnCl2溶液中加入Na2CO3,固体(忽略体积变化),如图为加入Na2CO3的物质的量与-1gc(Mg2+)或-lgc(Mn2+)之间的关系,已知常温下Ksp(MgCO3)>Ksp(MnCO3),下列说法正确的是( )
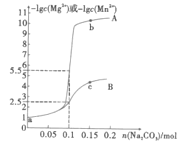
A.曲线A是n(Na2CO3)与-lgc(Mg2+)的关系曲线
B.Ksp(MnCO3)和Ksp(MgCO3)相差3个数量级
C.若将b点和c点溶液混合,存在![]() =1×106
=1×106
D.a点(MgCl2溶液)中存在:c(Mg2+)+c(H+)=c(OH-)+c(Cl-)
【答案】C
【解析】
已知常温下Ksp(MgCO3)>Ksp(MnCO3),则MnCO3溶解度更小,分别向1L0.1mol·L-1MgCl2和MnCl2溶液中加入Na2CO3固体,MnCO3更容易生成,溶液中剩余的Mn2+离子浓度更小,则曲线A为n(Na2CO3)与-lgc(Mn2+)的关系曲线,曲线B为n(Na2CO3)与-lgc(Mg2+)的关系曲线,据此分析。
已知常温下Ksp(MgCO3)>Ksp(MnCO3),则MnCO3溶解度更小,分别向1L0.1mol·L-1MgCl2和MnCl2溶液中加入Na2CO3固体,MnCO3更容易生成,溶液中剩余的Mn2+离子浓度更小,则曲线A为n(Na2CO3)与-lgc(Mn2+)的关系曲线,曲线B为n(Na2CO3)与-lgc(Mg2+)的关系曲线;
A.由分析可知,曲线A为n(Na2CO3)与-lgc(Mn2+)的关系曲线,故A错误;
B.由反应终点数据计算可知,Ksp(MnCO3)![]() 10-11, Ksp(MgCO3)
10-11, Ksp(MgCO3)![]() 10-5,相差6个数量级,故B错误;
10-5,相差6个数量级,故B错误;
C.![]() =
=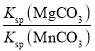 =
=![]() =106,故C正确;
=106,故C正确;
D.由MgCl2溶液中的电有守恒关系得2c(Mg2+)+c(H+)=c(OH-)+c(Cl-),故D错误;
故答案选C。

 智慧小复习系列答案
智慧小复习系列答案