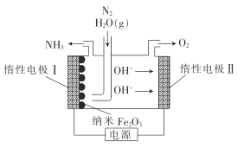
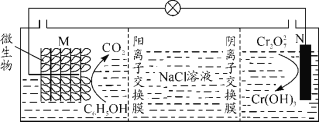
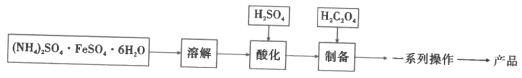
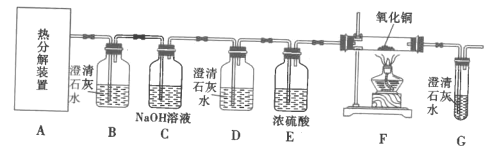
题目内容
【题目】以菱镁矿(主要成分是碳酸镁,含少量FeCO3和不溶性杂质)为原料制取硫酸镁晶体(MgSO4·7H2O)的流程如图:
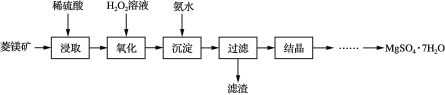
(1)“浸取”时通常将菱镁矿石进行粉碎,其目的是___。
(2)写出碳酸镁与稀硫酸反应的化学方程式___。
(3)“氧化”和“沉淀”是将“浸取”过程中产生的Fe2+转化为Fe(OH)3沉淀,则“过滤”所得滤液中含有的阳离子主要有___和___。
【答案】加快反应速率、提高固体浸出率 MgCO3+H2SO4=MgSO4+CO2↑+H2O ![]() Mg2+
Mg2+
【解析】
向菱镁矿中加入稀硫酸后,溶液中溶质为硫酸镁、硫酸亚铁,然后加入双氧水后,硫酸亚铁被氧化为硫酸铁,溶质主要成分为硫酸铁、硫酸镁,然后滴加氨水调节pH,使铁离子沉淀,过滤后滤液中主要成分为硫酸镁、硫酸铵,然后经过一系列操作得到MgSO4·7H2O,以此解答本题。
(1)浸取过程将将菱镁矿石进行粉碎,其目的是加快化学反应速率、提高固体浸出率;
(2)碳酸镁与稀硫酸反应生成硫酸镁、二氧化碳、水,其反应方程式为:MgCO3+H2SO4=MgSO4+CO2↑+H2O;
(3)由上述分析可知,过滤后滤液中主要阳离子有:Mg2+、![]() 。
。

练习册系列答案
相关题目