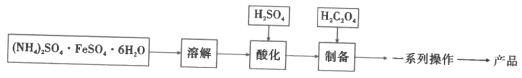
题目内容
【题目】研究水体中碘的存在形态及其转化是近年的科研热点。I-与I2在水体和大气中的部分转化如下图所示。
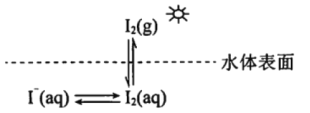
(1) I2的电子式为______________。
(2)水体中的I-在非酸性条件下难于被空气中的![]() 氧化。原因是
氧化。原因是![]() 的反应速率慢,反应程度小。
的反应速率慢,反应程度小。
①I-在酸性条件下与![]() 反应的离子方程式是_____________________________________。
反应的离子方程式是_____________________________________。
②在酸性条件下I-易被![]() 氧化的可能的原因是______________________________________。
氧化的可能的原因是______________________________________。
(3)有资料显示:水体中若含有![]() ,会对
,会对![]() 氧化I-产生影响。为检验这一结论,进行如下探究实验:分别将等量的
氧化I-产生影响。为检验这一结论,进行如下探究实验:分别将等量的![]() 通入到
通入到![]() 下列试剂中,一段时间后,记录实验现象与结果。己知:每
下列试剂中,一段时间后,记录实验现象与结果。己知:每![]() 参与反应,生成
参与反应,生成![]() 。
。
序号 | 试剂组成 | 反应前溶液的 | 反应后溶液的 |
|
|
甲 |
| 5.3 | 11.0 | 约10% | |
乙 |
| 5.1 | 4.1 | 约100% | 大量 |
丙 |
| 5.2 | 3.5 | —— | 少量 |
①![]() _______________________。
_______________________。
②甲中反应为可逆反应,其离子方程式是________________________。
③比较甲、乙、丙实验,说明![]() 在实验乙中的作用并解释_______________________。
在实验乙中的作用并解释_______________________。
【答案】![]()
![]()
![]() 增大,
增大,![]() 减小,使平衡
减小,使平衡![]() 正向移动,反应易于进行等其他合理答案
正向移动,反应易于进行等其他合理答案 ![]()
![]()
![]() 或
或![]() 的氧化产物
的氧化产物![]() 与
与![]() 和
和![]() 反应产生的
反应产生的![]() 结合,促使该平衡正向移动,提高了
结合,促使该平衡正向移动,提高了![]() 的转化率等其他合理答案
的转化率等其他合理答案
【解析】
(1)根据成键方式书写电子式;(2)根据氧化还原反应原理书写反应方程式,并根据平衡移动原理分析解答;(3)根据实验数据及平衡移动原理分析解答。
(1) I2属于共价分子,电子式为:![]() ,故答案为:
,故答案为:![]() ;
;
(2)①根据题干信息分析,I-在酸性条件下被![]() 氧化生成I2,反应的离子方程式是
氧化生成I2,反应的离子方程式是![]() ;
;
②根据提给信息中I-在非酸性条件下被氧化的反应方程式分析知,在酸性条件下I-易被![]() 氧化的可能的原因是
氧化的可能的原因是![]() 增大,
增大,![]() 减小,使平衡
减小,使平衡![]() 正向移动,反应易于进行,故答案为:
正向移动,反应易于进行,故答案为:![]() ;
;![]() 增大,
增大,![]() 减小,使平衡
减小,使平衡![]() 正向移动,反应易于进行等;
正向移动,反应易于进行等;
(3)①验证Fe2+对O3氧化I-产生的影响时,必须排除其它干扰因素,所以A、B组对照实验中c(Cl-)要相同,即c(NaCl)=2c(FeCl2)=2×1.5×10-2mol/L=3×10-2mol/L,故答案为:3×10-2;
②O3氧化I-时溶液显碱性,说明生成了碱性物质或离子,离子方程式为:![]() ,故答案为:
,故答案为:![]() ;
;
③Fe2+具有强还原性,易被O3氧化生成Fe3+,Fe2+或Fe3+结合OH-生成弱碱,促使反应![]() 正向进行,提高I-转化率,故答案为:
正向进行,提高I-转化率,故答案为: ![]() 或
或![]() 的氧化产物
的氧化产物![]() 与
与![]() 和
和![]() 反应产生的
反应产生的![]() 结合,促使该平衡正向移动,提高了
结合,促使该平衡正向移动,提高了![]() 的转化率。
的转化率。

 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案【题目】甲、乙是两种常见的化合物,X、Y、Z是三种常见的单质。下表所列各组物质之间通过一步反应不能实现如图所示转化的是( )
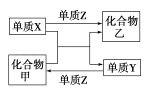
选项 | X | Y | Z | 甲 | 乙 |
A | C | H2 | O2 | H2O | CO |
B | Zn | Fe | Cl2 | FeCl2 | ZnCl2 |
C | Mg | C | O2 | CO2 | MgO |
D | H2 | Si | Cl2 | SiCl4 | HCl |
A.AB.BC.CD.D