题目内容
【题目】重铬酸钠是一种用途极广的氧化剂,工业上可以用铬铁矿[主要成分Fe(CrO2)2(或写成FeO·Cr2O3),还含有Al2O3、Fe2O3、SiO2等杂质]制备,同时还可回收Cr。其主要工业流程如图所示:

已知部分物质的溶解度曲线如图1所示。


图1 图2
请回答下列问题:
(1)煅烧生成Na2CrO4的化学方程式为______________________________。
(2)煅烧后的浸出液中除了含有NaOH、Na2CO3、Na2CrO4外,还含有_________(填化学式)。
(3)调节溶液的pH所选的试剂为__________________(填名称)。
(4)操作a的实验步骤为 _________________________。
(5)加入Na2S溶液反应后,硫元素全部以S2O32-的形式存在,写出生成Cr(OH)3的离子方程式__________________________________。
(6)采用石墨电极电解Na2CrO4溶液制备Na2Cr2O7,其原理如图2所示。
①写出电极b的电极反应方程式:___________________________________。
②测定阳极液中Na元素和Cr元素的含量,若Na元素与Cr元素的物质的量之比为n,则此时Na2CrO4的转化率为____________。
(7)根据有关国家标准,含CrO42-的废水要经化学处理,使其浓度降至5.0×10-7mol·L-1 以下才能排放。可采用加入可溶性钡盐生成BaCrO4沉淀[Ksp(BaCrO4)=1.2×10-10],再加入硫酸处理多余的Ba2+的方法处理废水,加入可溶性钡盐后,废水中Ba2+的浓度应不小于___________mol·L-1 ,废水处理后方能达到国家排放标准。
【答案】4Fe(CrO2)2+7O2+8 Na2CO3=2 Fe2O3+8 Na2CrO4+8CO2 Na2SiO3、 NaAlO2 稀硫酸 发浓缩、冷却结晶、过滤 23H2O+6S2-+ 8CrO42-= 8Cr(OH)3![]() + 3S2O32-+22OH-。 2H2O-4e-=O2
+ 3S2O32-+22OH-。 2H2O-4e-=O2![]() +4H+ (2-n)
+4H+ (2-n)![]() 100
100![]() ; 2.4×10-4
; 2.4×10-4
【解析】
根据铬铁矿的主要成分判断煅烧后的产物,根据杂质的成分及除杂产生的滤渣Al(OH)3和H2SiO3进行逆推,可知浸出液除了含有NaOH、Na2CO3、Na2CrO4外,还含有Na2SiO3, NaAlO2。根据电子守恒完成煅烧反应方程式;根据电池的正负极确定电解池的阴、阳极,根据氧化还原反应写电极反应方程式。
(1)铬铁矿主要成分Fe(CrO2)2,还含有Al2O3、Fe2O3、SiO2等杂质, 加入纯碱和空气高温煅烧生成Na2CrO4的化学方程式为:4Fe(CrO2)2+7O2+8Na2CO3=2 Fe2O3+8 Na2CrO4+8CO2;答案:4Fe(CrO2)2+7O2+8 Na2CO3=2 Fe2O3+8 Na2CrO4+8CO2。
(2) 根据调节pH后产生滤渣Al(OH)3和H2SiO3.可知加入纯碱和空气高温煅烧后,再加水过滤,浸出液中除了含有NaOH、Na2CO3、Na2CrO4外应该还会有Na2SiO3、NaAlO2。答案:Na2SiO3、NaAlO2。
(3)根据酸化产物有Na2SO4可知调节溶液的pH所选的试剂为稀硫酸。答案:稀硫酸。
(4)由溶液通过操作a后混合物分离为液体a和固体a两部分,从液体a可以提取重铬酸钠晶体,则固体a为硫酸钠晶体,根据溶解度曲线可知,硫酸钠的溶解度在较高温度下较小,在较低温度下也较小,故可以蒸发浓缩得到硫酸钠的饱和溶液,再降温结晶析出硫酸钠晶体,所以操作a为蒸发浓缩、冷却结晶、过滤;答案:蒸发浓缩、冷却结晶、过滤。
(5)加入Na2S溶液反应后,硫元素全部以S2O32-的形式存在,CrO42生成Cr(OH)3,的离子方程式:23H2O+6S2-+ 8CrO42-= 8Cr(OH)3![]() + 3S2O32-+22OH-。答案:23H2O+6S2-+ 8CrO42-= 8Cr(OH)3
+ 3S2O32-+22OH-。答案:23H2O+6S2-+ 8CrO42-= 8Cr(OH)3![]() + 3S2O32-+22OH-。
+ 3S2O32-+22OH-。
(6)①根据电池的正负极确定电解池b为阳极,电极反应方式为:2H2O-4e-=O2![]() +4H+;答案:2H2O-4e-=O2
+4H+;答案:2H2O-4e-=O2![]() +4H+;
+4H+;
②电解制备Na2Cr2O7过程的总反应方程式为Na2CrO+H2O = Na2Cr2O7+4NaOH+2H2![]() +O2
+O2![]() 设加入反应容器内的Na2CrO4为1mol,反应过程中有xmol Na2CrO4转化为Na2Cr2O7,则阳极区剩余Na2CrO4为(1-x)mol,对应的n(Na)=2(1-x), (1-x)mol,生成的Na2Cr2O7为x/2mol,对应的n(Na)=xmol, n(Cr)= xmol,根据: Na与Cr的物质的量之比为n,计算得出x=2-d,转化率为(2-n)/1
设加入反应容器内的Na2CrO4为1mol,反应过程中有xmol Na2CrO4转化为Na2Cr2O7,则阳极区剩余Na2CrO4为(1-x)mol,对应的n(Na)=2(1-x), (1-x)mol,生成的Na2Cr2O7为x/2mol,对应的n(Na)=xmol, n(Cr)= xmol,根据: Na与Cr的物质的量之比为n,计算得出x=2-d,转化率为(2-n)/1![]() 100
100![]() =(2-n)
=(2-n)![]() 100
100![]() ;答案:(2-n)
;答案:(2-n)![]() 100
100![]() ;
;
(7)国家标准含CrO42-的废水要经化学处理,使其浓度降至5.0×10-7mol·L-1,以下才能排放。 Ksp(BaCrO4)=,所以c(Ba2+)= Ksp(BaCrO4)/c(CrO42-)= 1.2×10-10/5.0×10-7=2.4×10-4;答案:2.4×10-4。

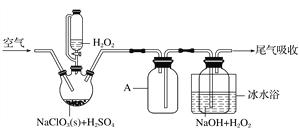
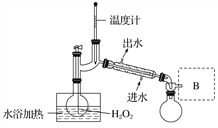
【题目】如图①、②、③、④、⑤五组仪器(可重复使用),选择合适的装置和药品能完成的实验是( )

选项 | 实验目的 | 实验装置 | 实验药品 |
A | 制备并收集HCl气体 | ①③④ | 浓盐酸、浓硫酸、水 |
B | 比较氯气和溴的氧化性强弱 | ①③③⑤ | MnO2、浓盐酸、饱和食盐水、溴化钾溶液、氢氧化钠溶液 |
C | 探究乙烯的加成反应 | ①③ | 无水乙醇、浓硫酸、溴的四氯化碳溶液 |
D | 探究二氧化硫的还原性 | ②③③ | 亚硫酸钠、30%的硝酸、溴水、氢氧化钠溶液 |
A. AB. BC. CD. D