题目内容
【题目】下列图示与对应的叙述相符的是

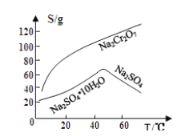
A. 图1表示相同温度下,pH=1的盐酸和醋酸溶液分别加水稀释时pH的变化曲线,其中曲线Ⅱ为盐酸,且b点溶液的导电性比a点强
B. 图2中仅升高温度,纯水就可以从a点变到c点
C. 图2中在b点对应温度下,将pH=2的H2SO4与pH=10的NaOH溶液等体积混合后,溶液显中性
D. 图3 表示H2与O2反应过程中的能量变化
【答案】C
【解析】
A.醋酸为弱酸,稀释能促进其电离,加水稀释后醋酸pH变化较小;
B.升高温度,促进水电离,氢离子和氢氧根离子浓度均增大;
C.b点Kw=10-12,中性溶液pH=6;
D.H2(g)与O2(g)反应生成H2O(l)或H2O(g)为放热反应.
A.醋酸为弱酸,稀释能促进其电离,加水稀释后醋酸pH变化较小,曲线Ⅱ为醋酸,且b点溶液的导电性比a点弱,故A错误;
B.升高温度促进水电离,氢离子和氢氧根离子浓度均增大,图2中从a点变到c点,氢氧根离子浓度不变,故B错误;
C.b点Kw=10-12,中性溶液PH=6;将pH=2的H2SO4与pH=10的NaOH溶液等体积混合后,氢离子浓度和氢氧根离子浓度相同,等体积混合溶液呈中性,故C正确;
D.H2(g)与O2(g)反应生成H2O(l)或H2O(g)为放热反应,气体水变化为液体水放热,图象能量大小关系错误,故D错误。
故选:C。

练习册系列答案
相关题目