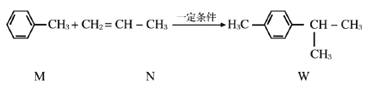
题目内容
【题目】可逆反应:2NO2(g) ![]() 2NO(g)+O2(g)在一恒容的密闭容器中反应,达到平衡状态的标志是( )
2NO(g)+O2(g)在一恒容的密闭容器中反应,达到平衡状态的标志是( )
①单位时间内生成n mol O2的同时生成2n mol NO2 ②单位时间内生成n mol O2的同时生成2n mol NO ③用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2∶2∶1的状态 ④混合气体的颜色不再改变的状态 ⑤混合气体的密度不再改变的状态 ⑥混合气体的平均相对分子质量不再改变的状态 ⑦混合气体的压强不再改变的状态
A. ①④⑥⑦ B. ②③⑤⑦ C. ①③④⑤ D. ①②③④⑤⑥
【答案】A
【解析】①用不同物质的反应速率表示达到平衡,反应方向是一正一逆,且反应速率之比等于化学计量数之比,生成氧气,反应向正反应方向进行,生成NO2反应方向向逆反应方向进行,且两者比值等于化学计量数之比,①能表示反应达到平衡,故①正确;②根据①的分析,②不能说明反应达到平衡,故②错误;③任何时刻三者速率之比等于2:2:1,③不能说明反应达到平衡,故③错误;④NO2红棕色气体,其余为无色气体,因此当气体颜色不再改变,说明反应达到平衡,故④正确;⑤根据ρ=m/V,组分都是气体,则气体质量不变,是恒容容器,气体体积不变,因此密度任何时刻都相等,即密度不变,不能作为达到平衡的标志,故⑤错误;⑥根据M=m/n,组分都是气体,气体质量不变,向正反应方向进行,气体物质的量增大,因此当气体平均摩尔质量不变时,说明反应达到平衡,故⑥正确;⑦因为反应前后气体系数之和不相等,因此当压强不再改变,说明反应达到平衡,故⑦正确;综上所述,选项A正确。

【题目】下列实验操作、现象与结论均正确的是
选项 | 实验操作 | 实验现象 | 结论 |
A | 25℃,两片相同的Al片分别和等体积的稀HNO3和浓HNO3反应 | 前者产生无色气体,后者产生红棕色气体,且后者反应更加剧烈 | 其他条件相同时,反应物浓度越大,反应速率越快 |
B | 往黄色固体难溶物PbI2中加水,振荡,静置。取上层清液,然后加入NaI固体 | 产生黄色沉淀 | 难溶物PbI2存在沉淀溶解平衡 |
C | 向蛋白质溶液中分别加入乙醇溶液和(NH4)2SO4饱和溶液 | 均产生白色沉淀 | 蛋白质均发生了变性 |
D | 向稀硫酸中加入铜片,然后通入氧气加热 | 开始无明显现象,通入氧气加热后溶液变蓝 | 氧化性:稀硫酸> Cu2+ |
A. A B. B C. C D. D
【题目】一定温度下,A、B、C三个容器中均进行同一个反应:N2(g)+3H2(g) ![]() 2NH3(g) ΔH =- Q kJ·mol-1,在相同的时间段内,测得如下数据:
2NH3(g) ΔH =- Q kJ·mol-1,在相同的时间段内,测得如下数据:
容器 | A | B | C |
反应速率/mol·L-1·min-1 | v(H2) = 3 | v(N2) = 3 | v(NH3) = 4 |
则三个容器放出的热量Q的大小关系为( )
A. B > C > A B. A > B > C C. C > A > B D. B > A > C