题目内容
【题目】298K时,向20mL 0.01mol·L-1 HF溶液中逐滴加入0.01mol·L-1 KOH溶液,其pH变化曲线如图所示。下列叙述正确的是( )
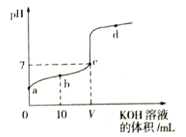
A. 水电离出的H+浓度:a<b<c<d
B. 氢氟酸的电离平衡常数:Ka=![]()
C. V=20
D. b点溶液中:c(F-)>c(HF)
【答案】D
【解析】
A.因为酸和碱都可抑制水的电离,氢氟酸与氢氧化钾反应生成的氟化钾水解可使溶液显碱性,促进了水的电离。由图像可知,a点只有氢氟酸、d点氢氧化钾过量较多,而c点接近滴定终点,故c点水的电离程度最大,A错误;B.由于c点pH=7,即c(H+)= c(OH-),由电荷守恒可知c( F- )= c(K+ )=V![]() 0. 01 mol/L /(20+V), c(F- ) +c(HF)=(20
0. 01 mol/L /(20+V), c(F- ) +c(HF)=(20![]() 10-3
10-3![]() 0.01mol/L)/ (20+V)
0.01mol/L)/ (20+V) ![]() 10-3=0.02/(20+V) mol/L,则 c(HF)= 0.02/(20+V)-0.01V/(20+V)=[(20-V)/ (20+V)]
10-3=0.02/(20+V) mol/L,则 c(HF)= 0.02/(20+V)-0.01V/(20+V)=[(20-V)/ (20+V)]![]() 0.01mol/L,所以氢氟酸的电离平衡常数:Ka= c( F- )
0.01mol/L,所以氢氟酸的电离平衡常数:Ka= c( F- ) ![]() c(H+)/ c(HF)= {10-7
c(H+)/ c(HF)= {10-7![]() [V
[V![]() 0. 01/(20+V)]}/ [(20-V)/ (20+V)]
0. 01/(20+V)]}/ [(20-V)/ (20+V)]![]() 0.01=V
0.01=V![]() 10-7/(20-V),故B错误。C. HF酸是弱酸,所以0. 01 mol/L的HF溶液中c(H+ )<0.01 mol/L。当加入氢氧化钾溶液的体积为20mL时,氢氟酸与氢氧化钾恰好反应生成的氟化钾水解可使溶液显碱性。c点pH=7,所以,加入的0.01mol·L-1 KOH溶液的体积小于20mL,即V<20,故C错误;D. b点表示等物质的量的HF和KF形成的混合溶液,溶液中存在电荷守恒:c(F-)+c(OH-)=c(K+ )+c(H+),物料守恒:c(F-)+c(HF)=2c(K+ ),两式联立消去钾离子项可得c(HF) +2c(H+ )=c(F-) +2c(OH-),以因为b点的pH<7, c(HF)< c(F-),故D正确;答案:D。
10-7/(20-V),故B错误。C. HF酸是弱酸,所以0. 01 mol/L的HF溶液中c(H+ )<0.01 mol/L。当加入氢氧化钾溶液的体积为20mL时,氢氟酸与氢氧化钾恰好反应生成的氟化钾水解可使溶液显碱性。c点pH=7,所以,加入的0.01mol·L-1 KOH溶液的体积小于20mL,即V<20,故C错误;D. b点表示等物质的量的HF和KF形成的混合溶液,溶液中存在电荷守恒:c(F-)+c(OH-)=c(K+ )+c(H+),物料守恒:c(F-)+c(HF)=2c(K+ ),两式联立消去钾离子项可得c(HF) +2c(H+ )=c(F-) +2c(OH-),以因为b点的pH<7, c(HF)< c(F-),故D正确;答案:D。

【题目】(1)利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤。已知:SO2(g) +1/2O2(g)![]() SO3(g) △H=-98 kJ·mol-1。某温度下该反应的平衡常数K=10/3,若在此温度下,向100 L的恒容密闭容器中,充入3.0 mol SO2(g)、16.0 mol O2(g)和3.0 mol SO3(g),则反应开始时v(正) _____v(逆)(填“<”、“>”或“=”)。
SO3(g) △H=-98 kJ·mol-1。某温度下该反应的平衡常数K=10/3,若在此温度下,向100 L的恒容密闭容器中,充入3.0 mol SO2(g)、16.0 mol O2(g)和3.0 mol SO3(g),则反应开始时v(正) _____v(逆)(填“<”、“>”或“=”)。
(2)下表列出了常见的烟气脱硝的两种方法
编号 | 名称 | 原理 |
方法一 | 尿素法 | 在温度70—95℃时,尿素CO(NH2)2溶液吸收NO、NO2,将其转化为N2 |
方法二 | 选择性催化还原( SCR)法 | 以NH3等作为还原剂,将烟气中的NOx还原生成N2和H2O |
已知:N2(g)+O2(g)=2NO(g) △H=+180.6 kJ·mol—1
N2(g)+3H2(g)=2NH3(g) △H= -92.4kJ·mol—1
2H2(g)+O2(g)=2H2O(g)△H= -483.6 kJ·mol—1
则4NO(g) +4NH3(g)+O2(g)=4N2(g)+6H2O(g);△H=_________ kJ·mol-1。
(3)CO和H2在一定条件下合成甲醇的反应为:CO(g)+2H2(g) ![]() CH3OH(g);ΔH。现在容积均为1L的a、b、c、d、e五个密闭容器中分别充入1molCO和2molH2的混合气体,控温,进行实验,测得相关数据如下图1和图2。
CH3OH(g);ΔH。现在容积均为1L的a、b、c、d、e五个密闭容器中分别充入1molCO和2molH2的混合气体,控温,进行实验,测得相关数据如下图1和图2。

①该反应的ΔH_______0(选填“<”、“>”或“=”,下同),K1_________K2。
②将容器c中的平衡状态转变到容器d中的平衡状态,可采取的措施有___。