题目内容
15.下列物质分离实验方案的设计中,不可行的是( )| A. | 用蒸馏的方法可以将海水淡化为可饮用水 | |
| B. | 用酒精萃取碘的水溶液中的碘 | |
| C. | 用分液的方法分离除去自来水中的固体悬浮杂质 | |
| D. | 加稀盐酸后过滤,除去混在铜粉中的少量锌粉 |
分析 A.海水中含有的杂质难挥发;
B.萃取剂的选择必须符合下列条件:溶质在萃取剂中的溶解度比在原溶剂中要大;萃取剂与原溶剂不相溶;萃取剂与溶质不反应;
C.分液分离能分层的液体;
D.金属锌和盐酸反应,但是金属铜不反应.
解答 解:A.海水中含有的杂质难挥发,可用蒸馏将海水淡化,故A正确;
B.酒精和水是互溶的,不能作为从碘水中萃取碘的萃取剂,故B错误;
C.过滤分离不溶物和可溶物,故C错误;
D.金属锌和盐酸反应,但是金属铜不反应,可除去,故D正确.
故选BC.
点评 本题考查物质的分离与除杂,难度不大,解决除杂问题时,抓住除杂质的必需条件(加入的试剂只与杂质反应,反应后不能引入新的杂质)是正确解题的关键.

练习册系列答案
相关题目
4.下列物质的电子式书写正确的是( )
| A. |  | B. | 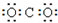 | C. |  | D. | 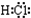 |
7.将1.92gCu和一定量的浓HNO3反应,随着Cu的不断减少,反应生成气体的颜色逐渐变浅,当铜粉完全溶解后共收集到由NO2和NO组成的混和气体1.12L(标准状况),则反应中所消耗硝酸的物质的量是( )
| A. | 0.08mol | B. | 0.12mol | C. | 0.09mol | D. | 0.11mol |
 间硝基苯胺(Mr=128)是一种重要的染料中间体.它是一种黄色针状结晶,微溶于水,随温度升高溶解度增大,溶于乙醇、乙醚、甲醇.间硝基苯胺可选用间二硝基苯与碱金属多硫化物进行选择性还原,其反应式如下:
间硝基苯胺(Mr=128)是一种重要的染料中间体.它是一种黄色针状结晶,微溶于水,随温度升高溶解度增大,溶于乙醇、乙醚、甲醇.间硝基苯胺可选用间二硝基苯与碱金属多硫化物进行选择性还原,其反应式如下: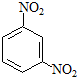 +Na2S2+H2O→
+Na2S2+H2O→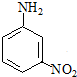 +Na2S2O3
+Na2S2O3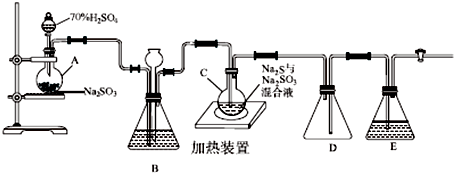
 通过粮食发酵可获得某含氧有机化合物X,其相对分子质量为46,其中碳的质量分数为52.2%,氢的质量分数为13.0%.
通过粮食发酵可获得某含氧有机化合物X,其相对分子质量为46,其中碳的质量分数为52.2%,氢的质量分数为13.0%. 运用相关原理,回答下列各小题:
运用相关原理,回答下列各小题: Fe(OH)3(胶体)+3H+.
Fe(OH)3(胶体)+3H+.