题目内容
4. 通过粮食发酵可获得某含氧有机化合物X,其相对分子质量为46,其中碳的质量分数为52.2%,氢的质量分数为13.0%.
通过粮食发酵可获得某含氧有机化合物X,其相对分子质量为46,其中碳的质量分数为52.2%,氢的质量分数为13.0%.(1)X的分子式是C2H6O;
(2)X与金属钠反应放出氢气,反应的化学方程式2CH3CH2OH+2Na-→2CH3CH2ONa+H2↑;
(3)X与空气中的氧气在铜或银催化下反应生成Y,Y的结构简式是CH3CHO;
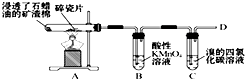
(4)X可以用某烃Z与水反应制备.图是石蜡油在炽热碎瓷片的作用下产生Z并检验其性质的实验,完成下列问题.
①B中反应类型是氧化反应;
②C中实验现象是溴的四氯化碳溶液褪色;
③制取氯乙烷(CH3CH2Cl)的最佳方法是(用化学方程式表示):CH2=CH2+HCl→CH3CH2Cl.
分析 (1)根据X的相对分子质量及各元素的质量分数可确定X的分子式;
(2)X与金属钠反应放出氢气,则X中含有羟基,据此确定X的结构简式,然后写出与钠反应的方程式;
(3)乙醇催化氧化生成乙醛,据此写出反应的化学方程式;
(4)①乙烯含有碳碳双键,能被酸性高锰酸钾氧化;
②乙烯能和溴发生加成反应;
③加成反应产物只有一种,无副产物生成,为制取氯乙烷(CH3CH2Cl)的最佳方法.
解答 解:(1)由题意知氧的质量分数为:1-52.2%-13.0%=34.8%,
则碳、氢、氧原子的个数分别为:N(C)=$\frac{46×52.2%}{12}$≈2、N(H)=$\frac{46×13.0%}{1}$≈6、N(O)=$\frac{46×34.8%}{16}$≈1,
则X的分子式为:C2H6O,
故答案为:C2H6O;
(2)因能与钠反应生成H2,所以X为乙醇,反应方程式为:2CH3CH2OH+2Na-→2CH3CH2ONa+H2↑,
故答案为:2CH3CH2OH+2Na-→2CH3CH2ONa+H2↑;
(3)乙醇可被氧化为乙醛,Y为乙醛,结构简式为:CH3CHO,
故答案为:CH3CHO;
(4)①乙烯分子中含有碳碳双键,能够被被酸性KMnO4氧化,发生了氧化反应,
故答案为:氧化反应;
②乙烯中含有一个碳碳双键,可以和溴发生加成反应,使溴的四氯化碳溶液褪色,
故答案为:溴的四氯化碳溶液褪色;
③加成反应产物只有一种,无副产物生成,故可选用乙烯与氯化氢制取氯乙烷,反应的方程式为:CH2=CH2+HCl→CH3CH2Cl,
故答案为:CH2=CH2+HCl→CH3CH2Cl.
点评 本题考查了乙烯的化学性质、氯代烃的制取等知识,题目难度中等,注意掌握乙烯的制法及化学性质,明确常见有机反应类型及判断方法,试题侧重考查学生的分析能力及化学实验能力.

 阅读快车系列答案
阅读快车系列答案| A. | 化学反应不一定有分子碰撞 | |
| B. | 发生有效碰撞的分子是活化分子 | |
| C. | 化学反应一定需要活化能 | |
| D. | 只要普通分子具有合适的取向就能产生有效碰撞 |
| A. | 用蒸馏的方法可以将海水淡化为可饮用水 | |
| B. | 用酒精萃取碘的水溶液中的碘 | |
| C. | 用分液的方法分离除去自来水中的固体悬浮杂质 | |
| D. | 加稀盐酸后过滤,除去混在铜粉中的少量锌粉 |
| A. | NO中有少量的NO2:用水洗涤后再干燥 | |
| B. | 食盐中有少量的NH4Cl:加过量的烧碱溶液后加热蒸干 | |
| C. | N2中有少量的O2:通过灼热的铜网 | |
| D. | CO2中混有少量的SO2气体:通过饱和NaHSO3溶液洗气 |
| A. | HAt很稳定 | B. | 易溶于某些有机溶剂 | ||
| C. | AgAt不溶于水 | D. | 是有色固体 |
①4Al(s)+3O2(g)=2Al2O3(s);△H=-2834.9kJ/mol;
②4Al(s)+2O3(g)=2Al2O3(s);△H=-3119.1kJ/mol.由此得出的正确结论是( )
| A. | 等质量的O2比O3的能量低,由O2变O3为放热反应 | |
| B. | 等质量的O2比O3的能量高,由O2变O3为吸热反应 | |
| C. | O2比O3稳定,3O2(g)═2O3(g)△H=-284.2 kJ/mol | |
| D. | O2比O3稳定,3O2(g)═2O3(g)△H=+284.2 kJ/mol |
| A. | 电池工作时,储氢合金作负极 | |
| B. | 电池充电时,阳极发生氧化反应 | |
| C. | 电池工作时,负极反应式:LaNi5H6+6OH--6e-═LaNi5+6H2O | |
| D. | 电池放电时,电子由正极通过外电路流向负极 |
| A. | 有白色沉淀生成,溶液颜色由浅绿色变棕色 | |
| B. | 有红褐色沉淀生成,上层溶液呈棕黄色 | |
| C. | 有无色无味的气体产生,该气体能使带火星的木条复燃 | |
| D. | 能看到溶液颜色加深,既无沉淀产生,也无气体放出 |