题目内容
19.有A、B、C均是由碳、氢、氧三种元素组成的有机物,它们的相对分子质量相等.但碳原子数依次减少一个.已知:①2.6g液态A在3.92L(标准状况下,下同)氧气中.经点燃后两者均恰好完全反应得到2.8L二氧化碳和液态水.
②A不能发生消去反应,但能与C发生缩聚生成聚酯D.
③B的溶液显酸性,分子中无甲基,一定条件下分子内部可脱水生成环状物E.
完成下列问题:
(1)A是一个1984年推放进市场的塑晶材料,白天光照后能吸收太阳能,夜间能释放出来,A的结构简式为:
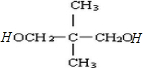 .
.(2)B分子内脱去一个水分子形成环状的化合物E,E的结构式为:
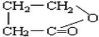 .
.(3)A与C可形成缩聚物D,D的结构简式为
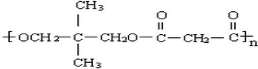 .
.(4)B′与B互为同分异构体,且是同类物质,写出满足条件的所有B′的结构简式:
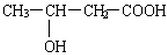 、
、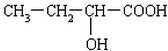 、
、 、
、 .
.
分析 ①标况下3.92L氧气的物质的量为:$\frac{3.92L}{22.4L/mol}$=0.175mol,氧气的质量为:32g/mol×0.175mol=5.6g,2.8L二氧化碳的物质的量为:$\frac{2.8L}{22.4L/mol}$=0.125mol,二氧化碳的质量为:44g/mol×0.125mol=5.5g,根据质量守恒,生成水的质量为:2.6g+5.6g-5.5g=2.7g,水的物质的量为:$\frac{2.7g}{18g/mol}$=0.15mol,根据O原子守恒,原有机物分子中含有O原子的物质的量为:0.15mol+0.125mol×2-0.175mol×2=0.05mol,所以A分子中C、H、O原子的数目之比为:0.175mol:(0.15mol×2):0.05mol=5:12:2,A的最简式为C5H12O2,由于该最简式中含有H原子数达到饱和,则A的最简式即为其分子式,
②A不能发生消去反应,但能与C发生缩聚生成聚酯D,则A分子中含有2个羟基,且与羟基相邻C上没有H,则A的结构简式为: ,
,
A、B、C均是由碳、氢、氧三种元素组成的有机物,它们的相对分子质量相等,但碳原子数依次减少一个,则B中含有4个C、C中含有3个C,则B中比A多1个O、少4个H原子,故B的分子式为:C4H8O3;C比A多2个O、少8个H,C的分子式为:C3H4O4;结合C能够发生缩聚反应可知C的结构简式为:HOOCCH2COOH,
③B的溶液显酸性,分子中无甲基,一定条件下分子内部可脱水生成环状物E,则B分子中含有羧基和羟基,其结构简式为:CH2(OH)CH2CH2COOH,据此进行解答.
解答 解:①标况下3.92L氧气的物质的量为:$\frac{3.92L}{22.4L/mol}$=0.175mol,氧气的质量为:32g/mol×0.175mol=5.6g,2.8L二氧化碳的物质的量为:$\frac{2.8L}{22.4L/mol}$=0.125mol,二氧化碳的质量为:44g/mol×0.125mol=5.5g,根据质量守恒,生成水的质量为:2.6g+5.6g-5.5g=2.7g,水的物质的量为:$\frac{2.7g}{18g/mol}$=0.15mol,根据O原子守恒,原有机物分子中含有O原子的物质的量为:0.15mol+0.125mol×2-0.175mol×2=0.05mol,所以A分子中C、H、O原子的数目之比为:0.175mol:(0.15mol×2):0.05mol=5:12:2,A的最简式为C5H12O2,由于该最简式中含有H原子数达到饱和,则A的最简式即为其分子式,
②A不能发生消去反应,但能与C发生缩聚生成聚酯D,则A分子中含有2个羟基,且与羟基相邻C上没有H,则A的结构简式为: ;
;
A、B、C均是由碳、氢、氧三种元素组成的有机物,它们的相对分子质量相等,但碳原子数依次减少一个,则B中含有4个C、C中含有3个C,则B中比A多1个O、少4个H原子,故B的分子式为:C4H8O3;C比A多2个O、少8个H,C的分子式为:C3H4O4;结合C能够发生缩聚反应可知C的结构简式为:HOOCCH2COOH;
③B的溶液显酸性,分子中无甲基,一定条件下分子内部可脱水生成环状物E,则B分子中含有羧基和羟基,其结构简式为:CH2(OH)CH2CH2COOH,
(1)根据分析可知,A的结构简式为: ,
,
故答案为: ;
;
(2)B的结构简式为CH2(OH)CH2CH2COOH,其分子中含有羟基和羧基,能够发生缩聚反应,生成产物的结构简式为: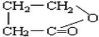 ,
,
故答案为: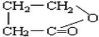 ;
;
(3)A的结构简式为 ,C为HOOCCH2COOH,二者分子分别含有两个羟基、两个羧基,可形成缩聚物D,则D的结构简式为:
,C为HOOCCH2COOH,二者分子分别含有两个羟基、两个羧基,可形成缩聚物D,则D的结构简式为: ,
,
故答案为: ;
;
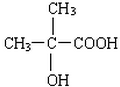
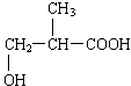
(4)B的结构简式为CH2(OH)CH2CH2COOH,B′与B互为同分异构体,且是同类物质,则B′分子中含有1个羧基和1个羟基,其可能的结构简式有: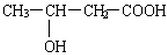 、
、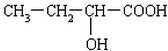 、
、 、
、 ,
,
故答案为: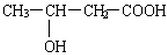 、
、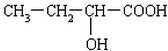 、
、 、
、 .
.
点评 本题考查了有机推断,题目难度较大,根据题中信息正确推断A、B、C的结构简式为解答关键,注意掌握常见有机物结构与性质,明确同分异构体的概念及书写原则,试题培养了学生的分析能力及灵活应用基础知识的能力.

 中考解读考点精练系列答案
中考解读考点精练系列答案 如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.据此下列说法错误的是( )
如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.据此下列说法错误的是( )| A. | 该硫酸具有强烈的腐蚀性,应放于危险化学用品柜中妥善保管 | |
| B. | 取10 mL该硫酸于烧杯中,再加18.4 mL的水,可配得49%的硫酸 | |
| C. | 配制200 mL 4.6 mol•L-1的稀硫酸需取该硫酸50 mL | |
| D. | 该硫酸与等质量的水混合所得溶液的物质的量浓度小于9.2 mol•L-1 |
| A. | c(Z)=0.45 mol•L-1 | B. | c(Z)=1.20 mol•L-1 | C. | c(W)=1.00 mol•L-1 | D. | c(W)=0.80 mol•L-1 |
①加热试管时,先均匀加热,后局部加热;
②用排水法收集气体时,先移出导管后撤酒精灯;
③制取物质时,先检查装置气密性后装药品;
④使用容量瓶、分液漏斗、滴定管前,先检查是否漏水后洗涤干净;
⑤做H2还原CuO实验时先加热CuO后通H2;反应完毕后,先撤酒精灯待试管冷却后停止通H2.
| A. | 除②以外 | B. | 除④以外 | C. | 除⑤以外 | D. | 全部正确 |
| A. | 植物光合作用:光能→生物质能 | B. | 太阳能热水器:太阳能→电能 | ||
| C. | 石灰石高温分解:热能→化学能 | D. | 铅蓄电池:化学能→电能 |
 某混合溶液中可能含有的离子如下表所示:
某混合溶液中可能含有的离子如下表所示:| 可能大量含有的阳离子 | H+、Ag+、Mg2+、Al3+、NH4+、Fe3+ |
| 可能大量含有的阴离子 | Cl-、Br-、I-、CO32-、AlO2- |
(1)探究一:
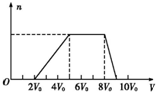
甲同学取一定量的混合溶液,向其中逐滴加入氢氧化钠溶液,产生沉淀的物质的量(n)与加入氢氧化钠溶液的体积(V)的关系如图所示.
①该溶液中一定不存在的阳离子是Mg2+、Fe3+、Ag+,一定不存在的阴离子是CO32-、AlO2-;含有的阳离子其对应物质的量浓度之比为H+、NH4+、Al3+为2:3:1;
②请写出沉淀减少过程中发生反应的离子方程式Al(OH)3+OH-=AlO2-+2H2O.
(2)探究二:
乙同学检测到该溶液中含有大量的Cl-、Br-、I-,若向1L该混合溶液中通入一定量的Cl2,溶液中Cl-、Br-、I-的物质的量与通入Cl2的体积(标准状况)的关系如下表所示,分析后回答下列问题:
| Cl2的体积(标准状况) | 11.2L | 22.4L | 28.0L |
| n(Cl-) | 2.5mol | 3.5mol | 4.0mol |
| n(Br-) | 3.0mol | 2.5mol | 2.0mol |
| n(I-) | x mol | 0 | 0 |
②原溶液中Cl-、Br-、I-的物质的量浓度之比为1:2:1.
 .
.