题目内容
【题目】实验室模拟“侯氏制碱法”原理,以NaCl、NH3、CO2等为原料先制得NaHCO3,进而生产出纯碱。有关反应的化学方程式为NH3+CO2+H2O=NH4HCO3;NH4HCO3+NaCl=NaHCO3↓+NH4Cl;2NaHCO3![]() Na2CO3+CO2↑+H2O。
Na2CO3+CO2↑+H2O。
(1)利用上述反应原理,设计如图所示装置,制取碳酸氢钠晶体,C烧杯中盛有冰水,D中装有蘸稀硫酸的脱脂棉,图中夹持装置已略去。
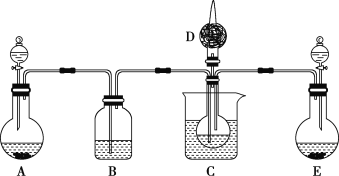
①E中制备气体时,所需药品是___(填字母)。
a.石灰石 b.生石灰 c.稀盐酸 d.浓氨水
②B中应盛有___溶液。在实验过程中,应向C中先通入足量的__。
③E装置向C中通气的导管不能插入液面下的原因是___。
(2)该小组同学为了测定C中所得碳酸氢钠晶体的纯度(假设晶体中不含碳酸盐杂质),将晶体充分干燥后,称量质量为4g。再将晶体加热到质量不再变化时,称量所得粉末质量为mg。然后进行如图所示实验:
![]()
![]()
![]()
![]()
![]()
![]()
①在操作Ⅱ中,为了判断加入氯化钙溶液是否过量,正确的实验操作是:在加入氯化钙溶液后,___。
②操作Ⅲ涉及的步骤名称为___、___、干燥。
③所得晶体中碳酸氢钠的纯度为____%。
【答案】bd 饱和碳酸氢钠 氨气(或NH3) NH3极易溶于水 振荡、静置,向溶液中继续加入少量氯化钙溶液 过滤 洗涤 96.6
【解析】
(1)E中气体通入C中时,导管口没有深入液体中,A中生成的气体通入C中时,导管口深入液体中,说明A中制取的是二氧化碳、E中制取的是氨气;B装置的作用是除去二氧化碳中的氯化氢;
(2)碳酸氢钠加热分解为碳酸钠,碳酸钠能与氯化钙溶液反应生成碳酸钙沉淀,根据碳酸钙沉淀的质量可计算碳酸氢钠的质量。
(1)根据以上分析,①E中制备氨气,装置没有加热,浓氨水和生石灰混合能放出氨气,所以需要药品是生石灰、浓氨水,选bd。
②B装置的作用是除去二氧化碳中的氯化氢,B中应盛有饱和碳酸氢钠溶液。氨气在水中的溶解度大于二氧化碳,所以在实验过程中,应向C中先通入足量的氨气。
③氨气极易溶于水,易引起倒吸,E装置向C中通气的导管不能插入液面下的原因是氨气极易溶于水,防倒吸。
(2)①若氯化钙不过量,则溶液中含有碳酸根离子,再加入氯化钙溶液会继续生成碳酸钙沉淀,为了判断加入氯化钙溶液是否过量,正确的实验操作是:在加入氯化钙溶液后,振荡、静置,向溶液中继续加入少量氯化钙溶液,若没有沉淀生成,则氯化钙过量。
②操作Ⅲ为从固液混合物中分离出固体,步骤名称依次为过滤、洗涤、干燥。
③碳酸氢钠加热分解为碳酸钠,反应方程式是2NaHCO3![]() Na2CO3+CO2↑+H2O,碳酸钠能与氯化钙溶液反应生成碳酸钙沉淀,反应方程式是Na2CO3+CaCl2=CaCO3+2NaCl,反应总关系式是2NaHCO3——CaCO3,
Na2CO3+CO2↑+H2O,碳酸钠能与氯化钙溶液反应生成碳酸钙沉淀,反应方程式是Na2CO3+CaCl2=CaCO3+2NaCl,反应总关系式是2NaHCO3——CaCO3,
设碳酸氢钠的质量为xg
2NaHCO3——CaCO3
168 100
x 2.3
![]() x=3.864g
x=3.864g
晶体中碳酸氢钠的纯度为![]() ×100%=96.6%。
×100%=96.6%。

 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案【题目】现有部分短周期元素的性质或原子结构如表:
元素编号 | 元素性质或原子结构 |
A | 有3个电子层,K、M层电子数之和等于L层电子数 |
B | 短周期中金属性最强 |
C | 常温下单质为双原子分子,氢化物的水溶液呈碱性 |
D | 元素最高正价是+7价 |
用化学用语回答下列问题:
(1)A元素在周期表中的位置 __________________;
(2)B单质与水反应的离子方程式 ______________________;
(3)下列表述中能证明元素D的非金属性比A强这一事实的是 _____________(填选项序号)。
a.常温下D的单质和A的单质状态不同
b.一定条件下D和A的单质都能与钠反应
c.A最高价含氧酸的酸性弱于D最高价含氧酸
d.D单质能与A的氢化物反应生成A单质
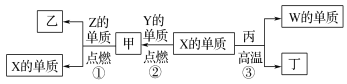
(4)X是由A、B、C、D四种元素中的某种元素组成的单质,能经图所示的过程转化为(其他条件略去)。![]()
①若Y是有刺激性气味的无色气体,把Y通入BaCl2溶液中,无现象,然后滴加适量H2O2溶液,有白色沉淀生成,则该白色沉淀为 _________,试写出Y与H2O2溶液反应的离子方程式: __________________
②若Z是红棕色气体,则Z→W的反应中还原剂与氧化剂物质的量之比为_________。